金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
经常阅读近几年方法学的文章,会发现有一些方向的内容很容易发到很高影响因子的杂志,其中包括分子编辑、酶催化反应等等,说明这些研究是现在有机化学家的热门方向。大量的报道导致体系研究已趋于成熟,形成了固有的研究范式。
在此就“分子编辑”进行简单的讨论。现在报道的分子编辑的文章多如牛毛,也有一些相关的综述(Helv Chim Acta, 2023, 106(3): e202200182),但这些综述、包括research article的Scheme 1里多是按照反应类型来进行分类,如扩环反应,缩环反应,原子交换等。这种分类方式的唯一作用是通过特有的专业名词来凸显自己工作的优越性,并不能触及“分子编辑”的本质。我认为,要扯下听上去高大上的“分子编辑”这一概念的面纱,就需要从反应的本质去理解。在此,我认为目前报道的大多数分子编辑的工作按照中间体只需要分为三类:
1. 卡宾/氮宾的插入及类似(六并三或五并三元环中间体)
2. 4+2环加成
3. Zincke中间体
最近还有一个小热门的方向,即芳杂环上的官能团化,该研究的本质与我提出的以上三种途径高度重合,因此这里也一并总结。
1 卡宾/氮宾的插入
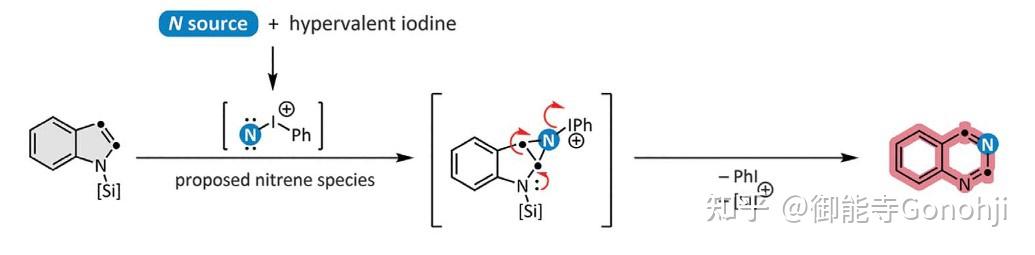
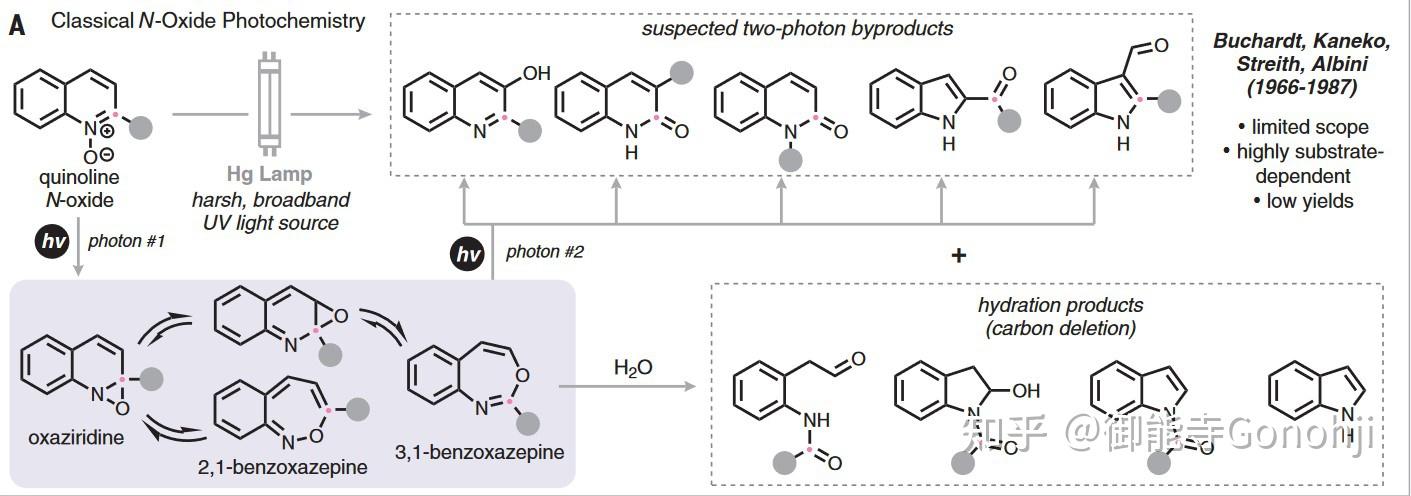
卡宾/氮宾与芳杂环上的一根双键发生插入反应,生成去芳构化的五并三元环或六并三元环。随后三元环开环,得到扩环的产物。对五并三元环,该过程常用于实现分子编辑中的扩环反应;而对于六并三元环,扩环后生成的是一个七元环。虽然七元环中间体是稳定的,但由于这种方式合成的七元环并无太多的利用价值(如在药物分子中不常见),因此后续会想办法将七元环缩回六元环或五元环,故该过程常用于实现分子编辑中的原子替换反应,也有用于缩环反应的报道。另外除卡宾/氮宾插入外,N氧化物也会经历类似的三元环并环-开环的过程,因此也可归类于这里。
1. Ciamician–Dennstedt rearrangement, 1881

吡咯合成吡啶(Ber. Dtsch. Chem. Ges. 1881, 14, 1153)
应用:
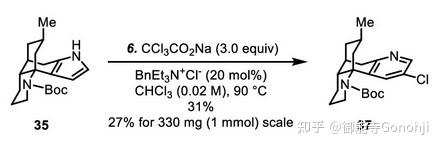
代明骥,J. Am. Chem. Soc. 2021, 143, 40, 16383
2. 吲哚合成喹啉
Levin, J. Am. Chem. Soc. 2021, 143, 11337
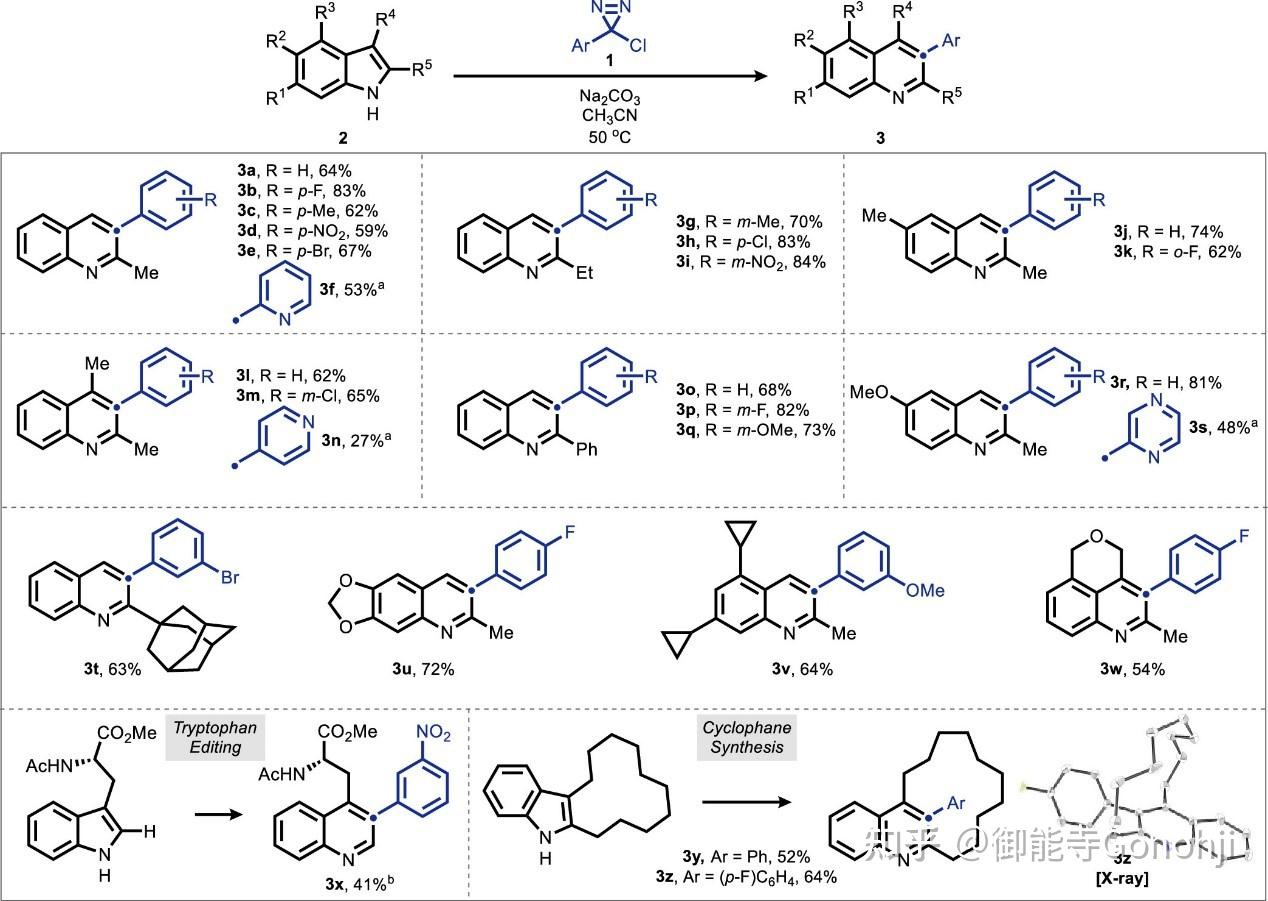
3. 吲哚合成喹唑啉
Morandi, Science 2022, 377, 1104
4. 喹啉合成吲哚
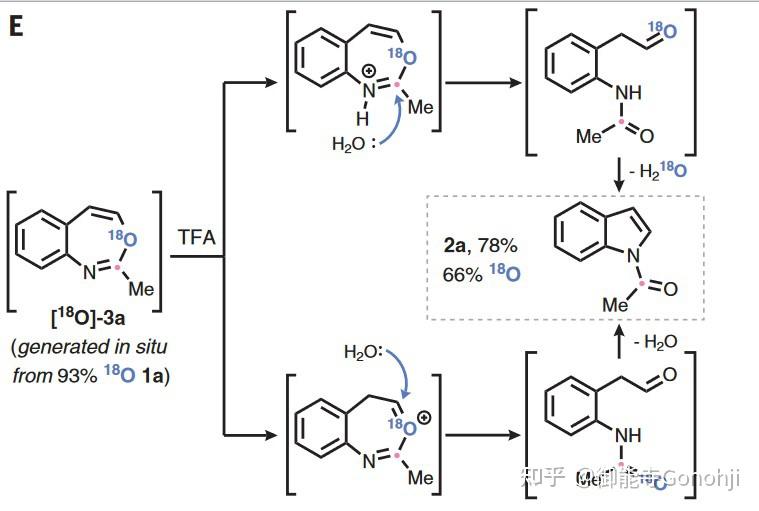
Levin, Science 2022, 376, 527
5. 苯环合成吡啶
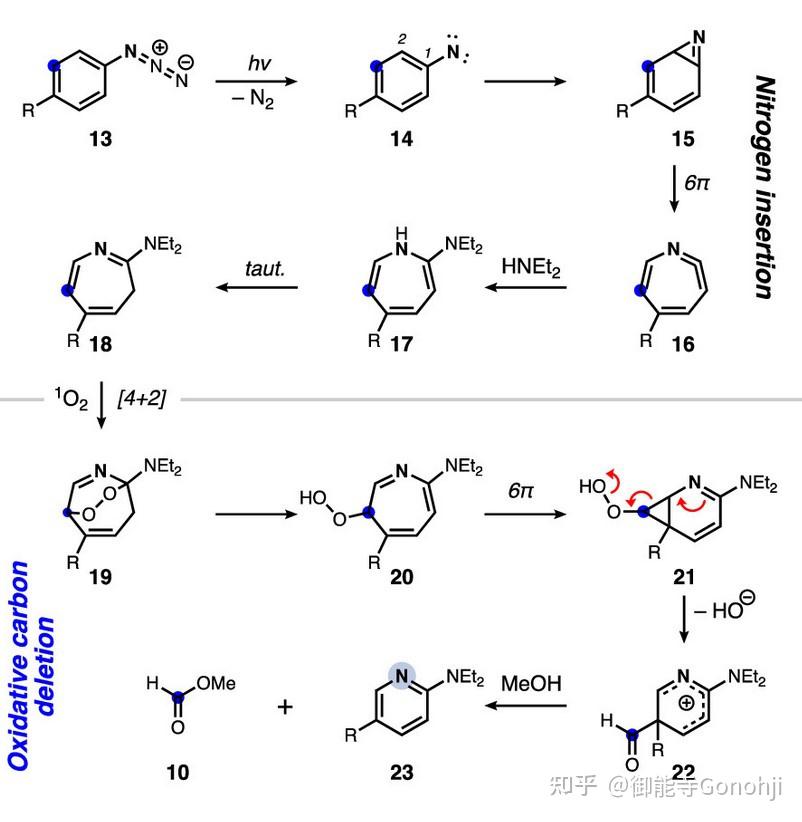
Burns, J. Am. Chem. Soc. 2022, 144, 17797
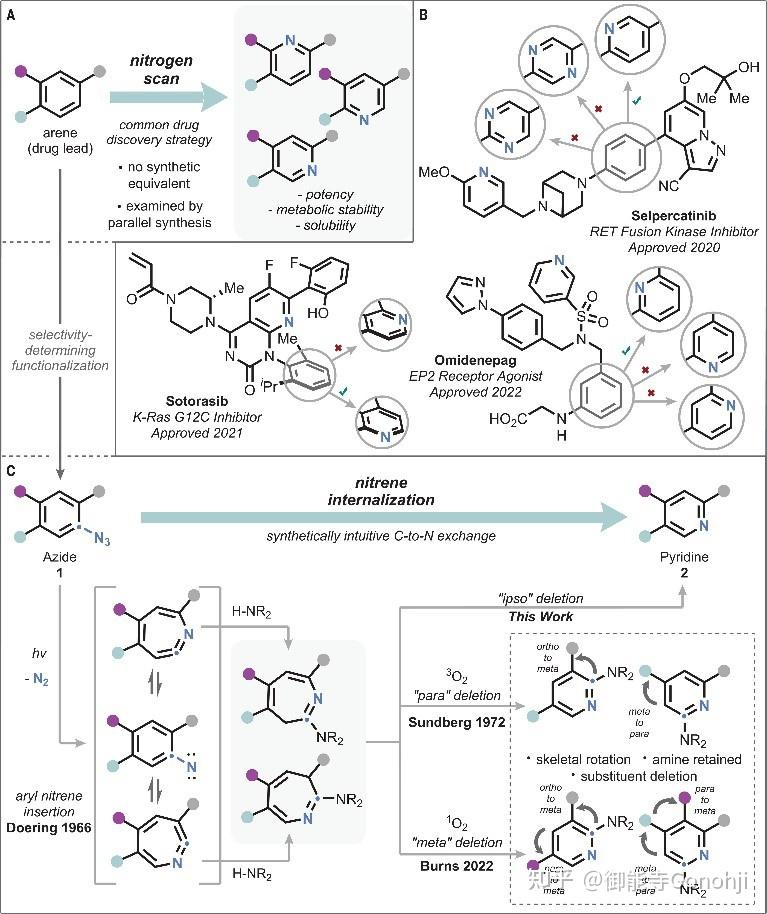
Levin, Science, 2023, 381(6665): 147
6. 硝基苯的双官能团化
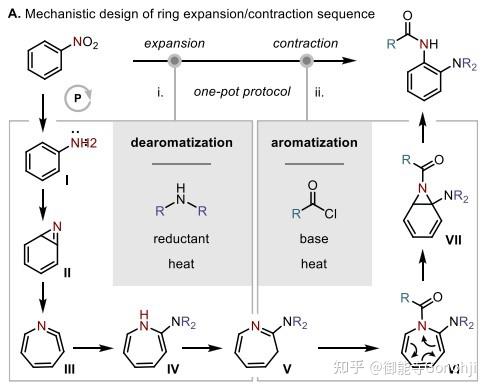
Alexander Radosevich, J. Am. Chem. Soc. 2023, 145, 1, 41
7. 还有一种类型的分子编辑在脂肪胺上删N,两侧生成烷基自由基,该过程本质也是氮宾介导的。
1)二级脂肪胺脱N自偶联
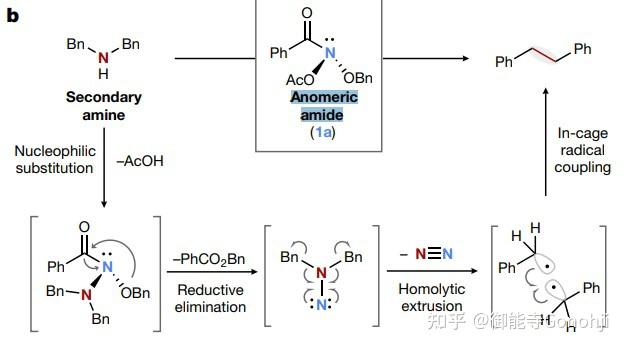
Levin, Nature 2021, 593(7858): 223 (开山作)
2)如果用的伯胺,那么只会生成一个烷基自由基,可以用别的捕获剂捕获。

J. Am. Chem. Soc. 2021, 143, 17366(1就是他们的anomeric amide)
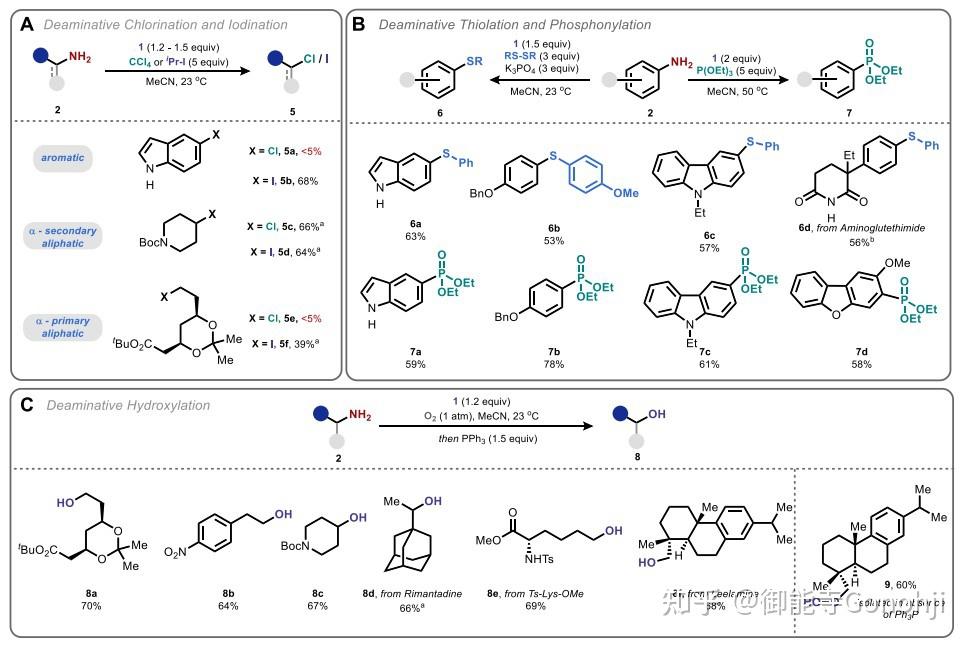
其他官能团化(卤代、硫醇化、磷酰化、羟基化)。J. Am. Chem. Soc. 2023, 145, 17
3)其他类似的活性物种。
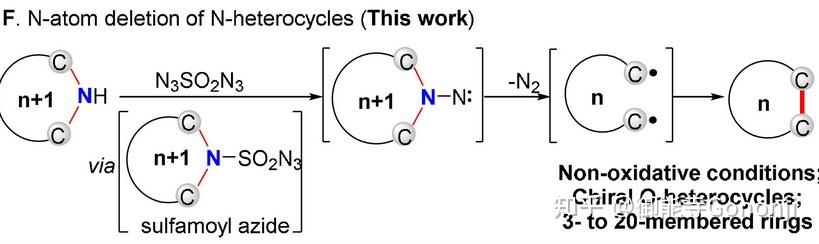
陆红健,Angew Chem Int Ed, 2021, 60: 20678
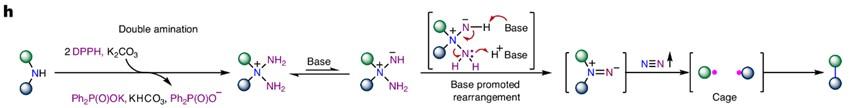
陆红健,Nat Synth, 2024: 1
2 [4+2]环加成
芳杂环由于有杂原子的存在,易于发生DA反应。DA后的桥环化合物在热力学驱动下通过逆DA和重芳构化形成更稳定的产物。这个过程与四氮嗪和炔烃的click反应一致,所以这个click也可以叫做分子编辑。
1. 异噁唑合成吡啶,烯烃做亲双烯体
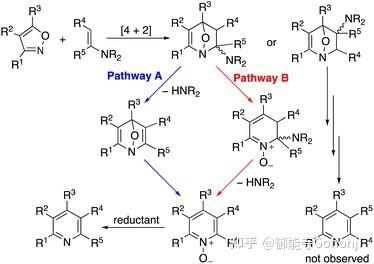
Aaron Odom, Org. Biomol. Chem. 2022, 20, 6630
2. 苯并异噁唑合成喹唑啉,亚胺做亲双烯体
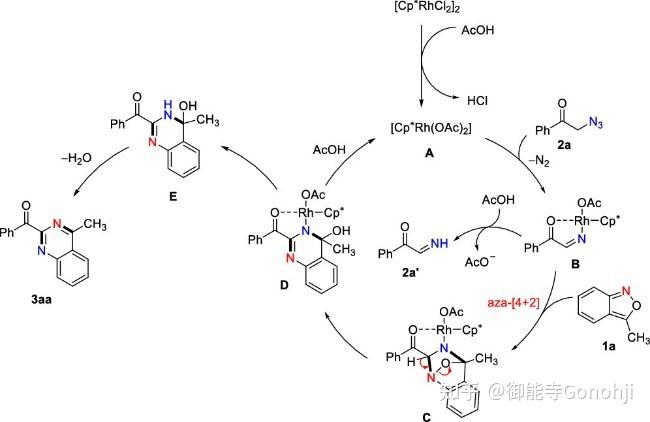
Yu, J. Org. Chem. 2022, 87, 11253
3. 噻吩合成苯环,炔烃做亲双烯体
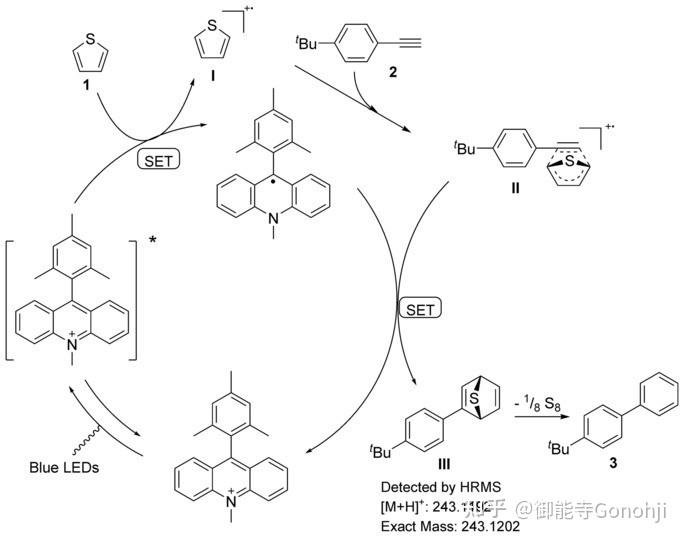
雷爱文,Angew. Chem. Int. Ed. 2019, 58, 12206
4. 吡啶合成苯环,炔烃做亲双烯体。另外吡啶活化的过程也是一个4+2.
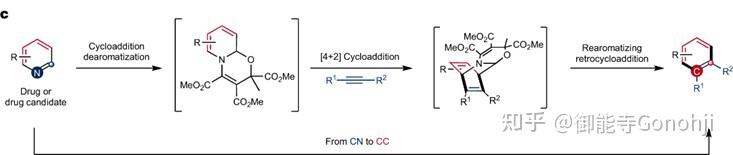
Studer, Nat Chem, 2024, 16(5): 741
另外Studer除了将活化吡啶的中间体用于骨架替换,还将其用于吡啶的间位官能团化:
1)开山作,讨论了活化吡啶的反应性(Science 2022, 378, 779)。
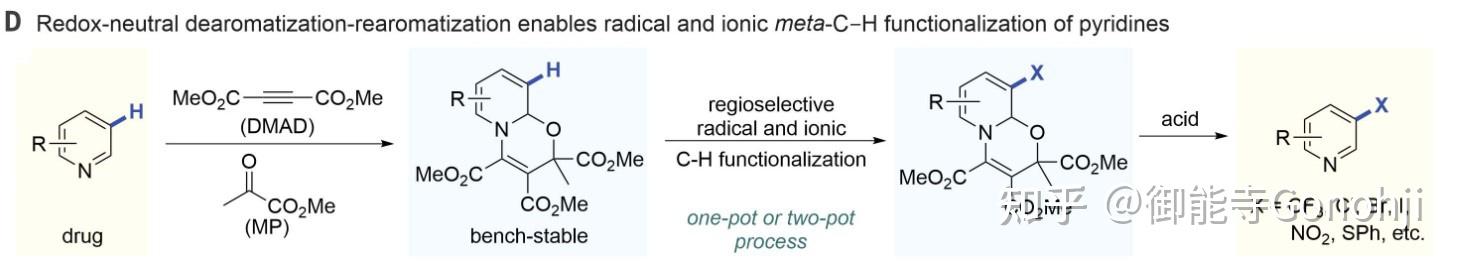
2)间位C-C键偶联(Angew. Chem. Int. Ed., 2024: e202405385)
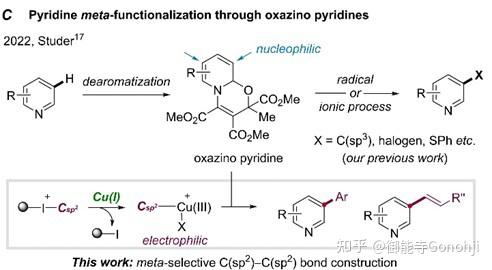
3)间位和对位官能团化的调节(Nat Comm, 2024, 15(1): 4121)
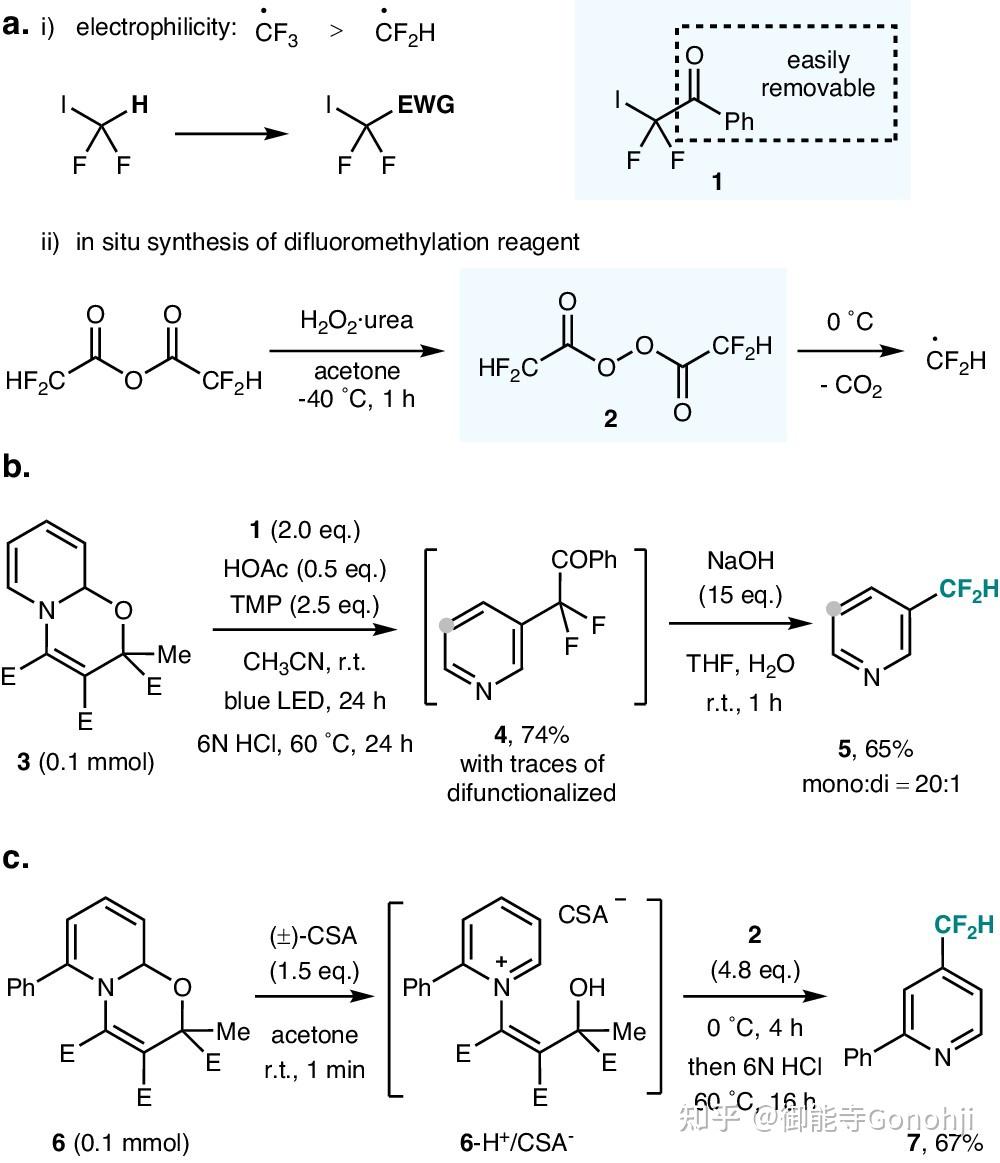
3 Zincke中间体
Zincke反应本来是用于吡啶氮鎓盐化合物的(图源微信公众号:有机合成):
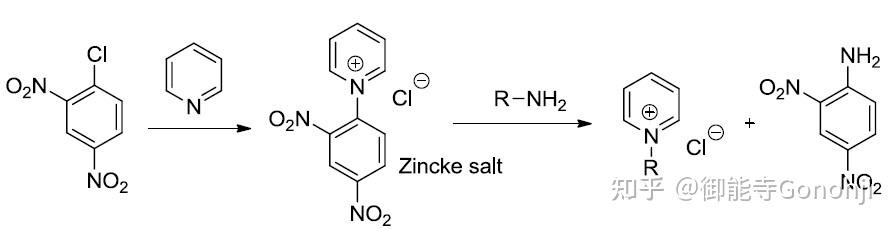
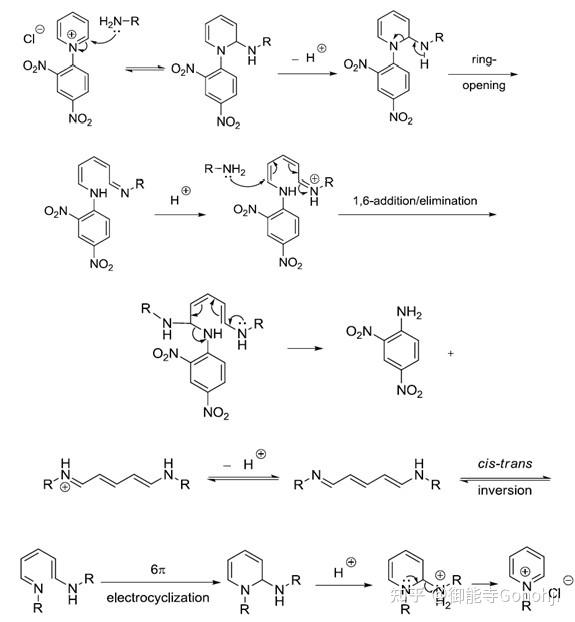
如果将亲核试剂由氨基变成碳中心的亲核试剂(如丙二酸二乙酯、二甲亚砜的甲基硫叶立德等),那么就可以实现杂环的N到C的替换。抑或是用肼,用末端的氨基来进攻亚胺,可以实现插N和缩环。另外开环后的亚胺Zincke中间体可以根据电荷的分布进行官能团化,最后再关环,即实现芳杂环的位点选择性官能团化。吡啶的活化试剂除了经典的2,4-二硝基氯苯,三氟甲磺酸酐也可以。
1. 嘧啶合成吡唑
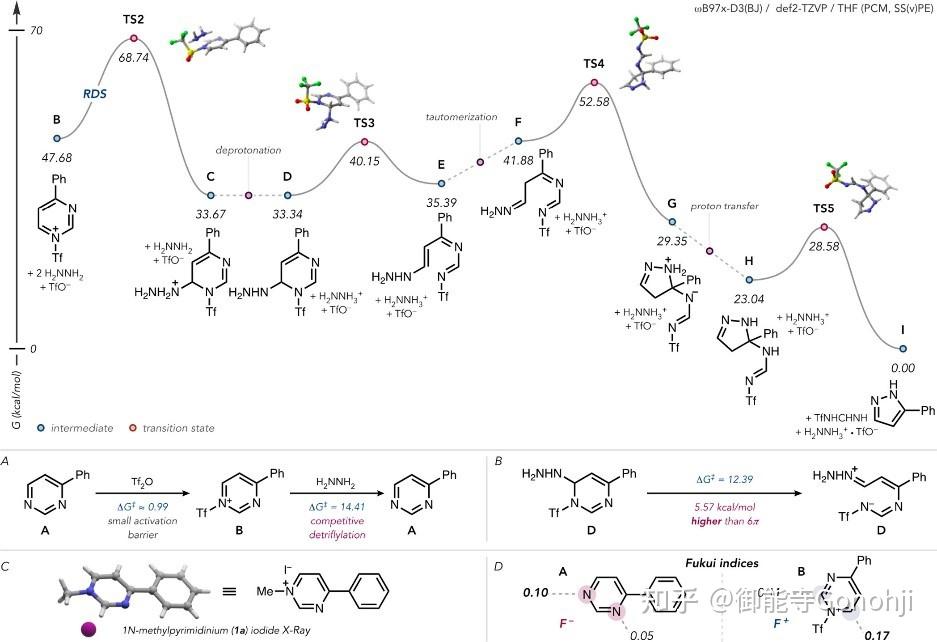
Sarpong, J. Am. Chem. Soc. 2022, 144, 22309
2. 吡唑合成嘧啶(如果只是卡宾插入的话只是得到吡啶,但这里还多了一个N,说明二氮吖啶的N也参与了反应)
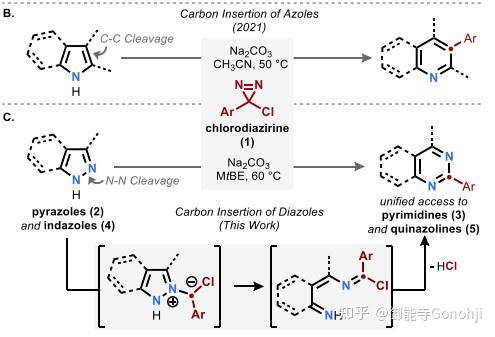
Levin, J. Am. Chem. Soc., 2022, 144(42): 19258
3. 吡啶合成苯环
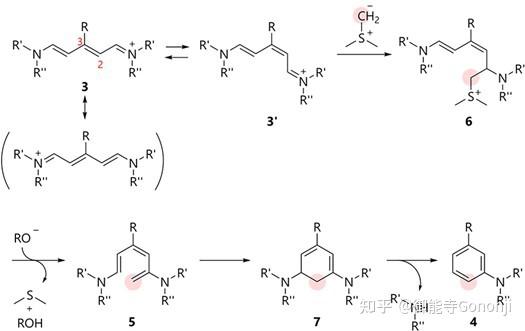
Kano, Org. Lett. 2021, 23, 15, 6126
4. 吡啶合成苯环
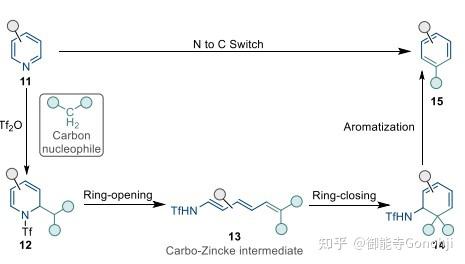
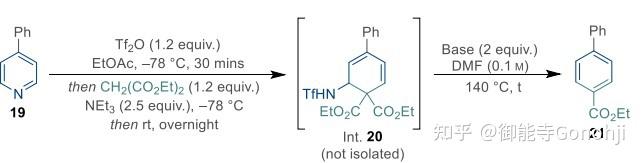
Greaney, Chem 2024, 10, 1940
5. 吡啶间位卤代
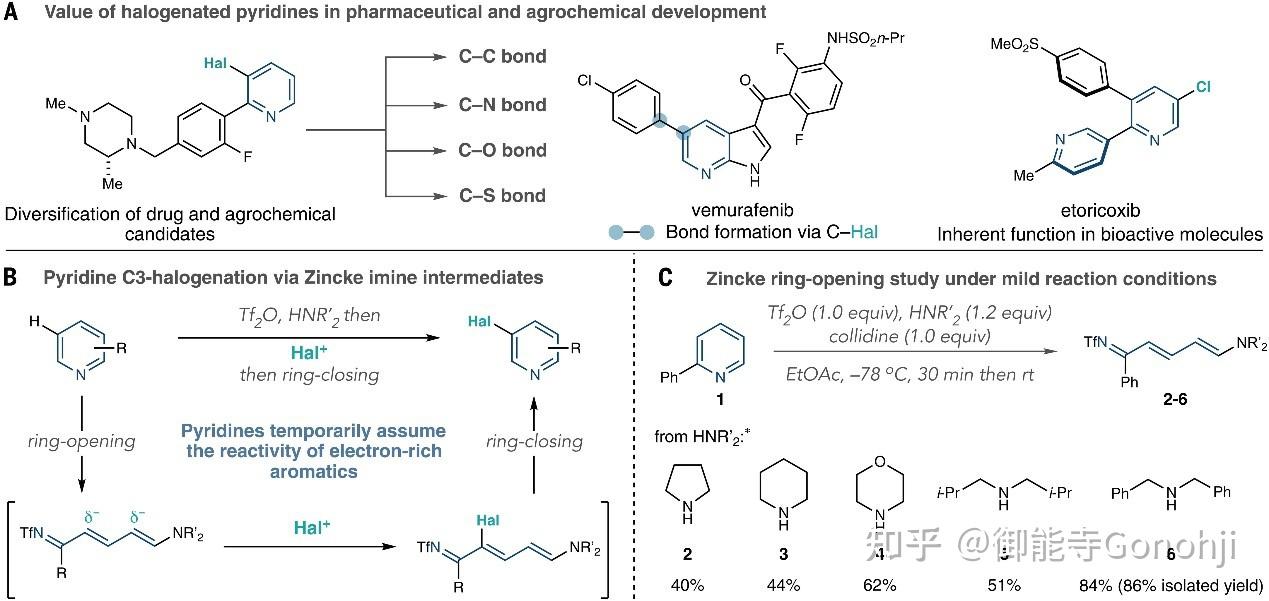
McNally, Science, 2022, 378, 773
6. 吡啶间位/对位C-C偶联
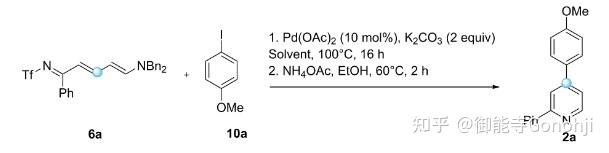
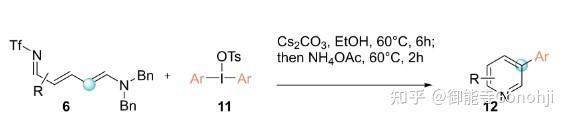
Greaney, Angew. Chem. Int. Ed. 2024, 63, e202315418
原文地址:https://zhuanlan.zhihu.com/p/707508239 |
|
 /3
/3 