登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
近年来,蛋白降解靶向嵌合体(PROTACs)作为一种革命性技术崭露头角。本期将深入解析 PROTACs 技术的核心原理与作用机制,梳理其在分子设计优化与临床转化中的最新突破与挑战! Section.01 靶向蛋白降解 (TPD) 的 细胞机制
靶向蛋白降解 (Targeted Protein Degradation, TPD) 是一类革命性治疗策略,其核心在于利用细胞自身的蛋白降解系统精准清除致病蛋白。这一快速发展的领域涵盖多种创新策略:如分子胶,PROTACs,溶酶体靶向嵌合体 (LYTACs),抗体-PROTAC (AbTACs)。 这些技术共同拓宽了疾病治疗的边界,为攻克传统药物难以靶向的 "不可成药" 蛋白提供了全新思路,在癌症、神经退行性疾病等领域展现出巨大潜力[1][2]。
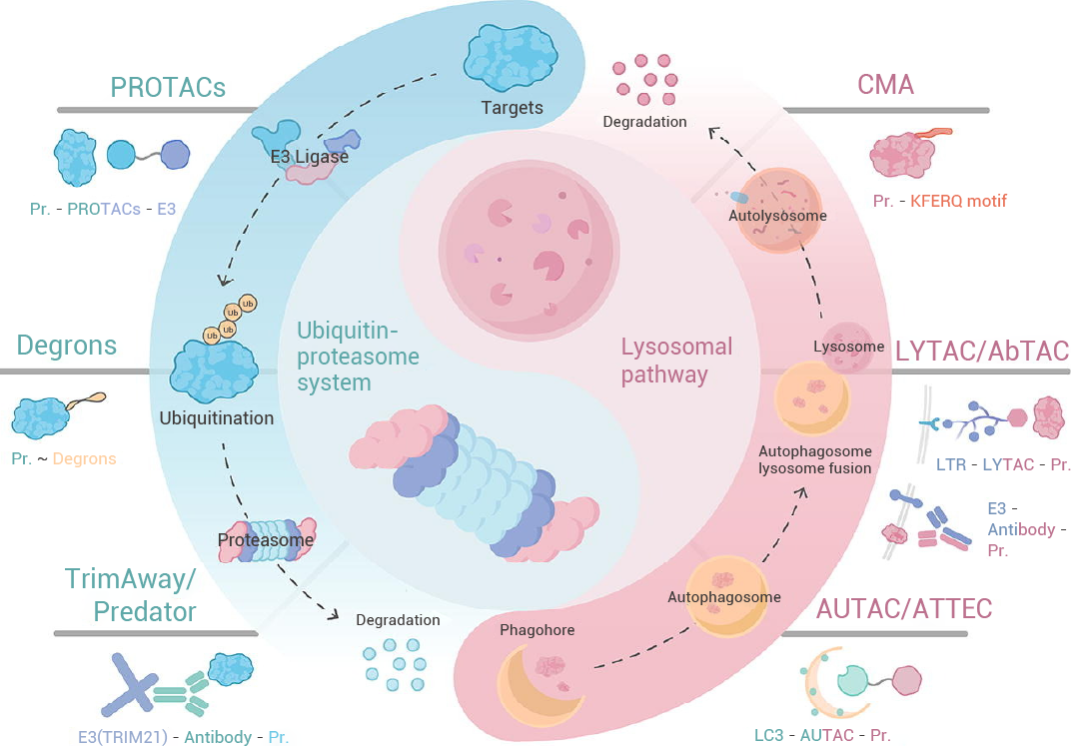 图 1. 常见的靶蛋白降解技术[1]。
在哺乳动物细胞中,蛋白质质量监控主要依赖两大 "清道夫" 系统:泛素-蛋白酶体系统和溶酶体系统。
泛素-蛋白酶体系统:精准"打标签"
溶酶体系统:细胞自噬的消化中心 溶酶体通过两大途径 "大显神通":
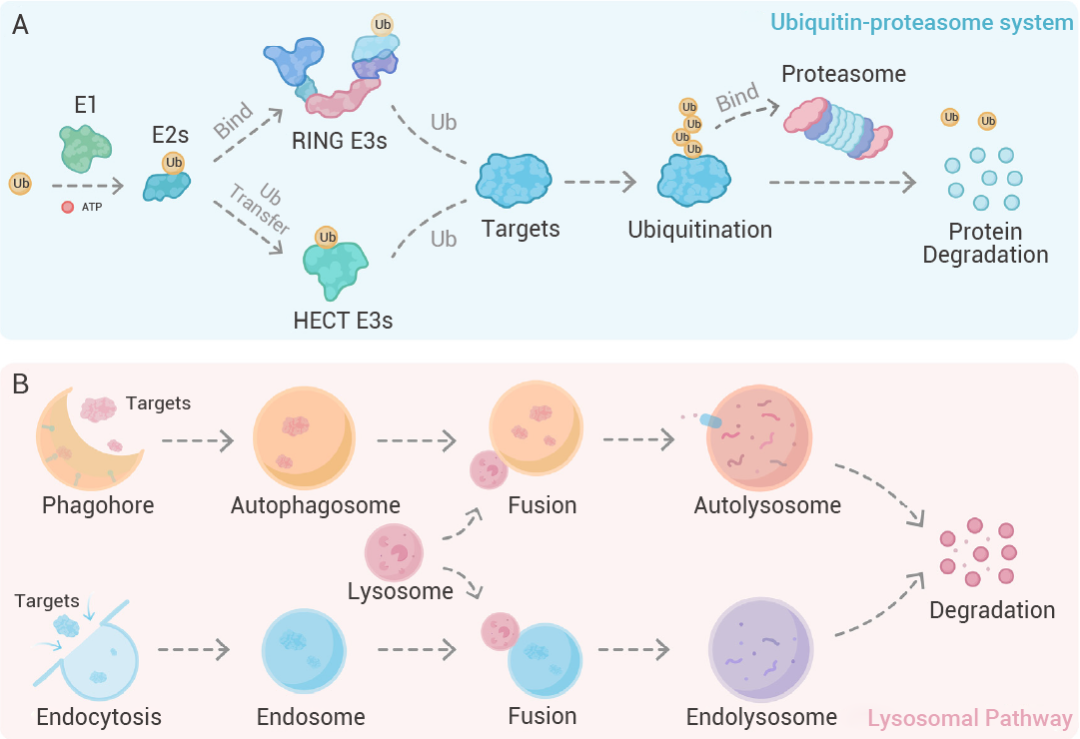 图 2. 泛素-蛋白酶体系统和溶酶体系[1]。
Section.02 PROTACs: 如何精准"爆破"致病蛋白?
蛋白降解靶向嵌合体 (PROTACs) 是 PDT 的众多策略中最受瞩目的技术之一。与传统小分子抑制剂不同,PROTACs 通过巧妙利用细胞固有的蛋白降解系统——泛素-蛋白酶体通路,实现致病蛋白的精准清除。这种 "借力打力" 的策略不仅为攻克传统 "不可成药" 靶点开辟全新路径,更为肿瘤、神经退行性疾病等疑难病症的治疗带来曙光[1]。
结构三要素:靶向、连接、降解
作用机制:单个分子可循环降解多个靶蛋白
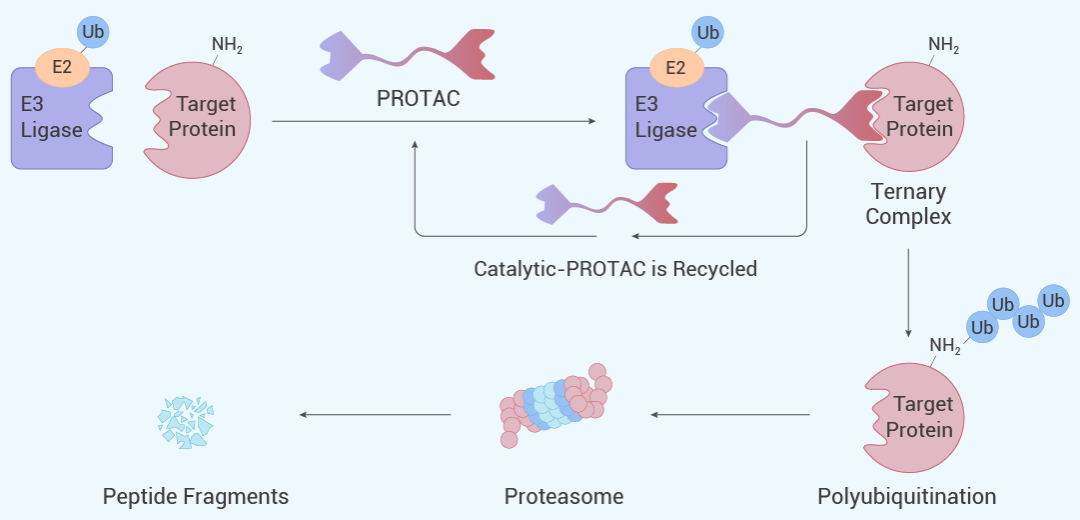 图 3. PROTAC 的组成以及作用机制[3]。
PROTACs 与其他治疗模式的比较[3]。 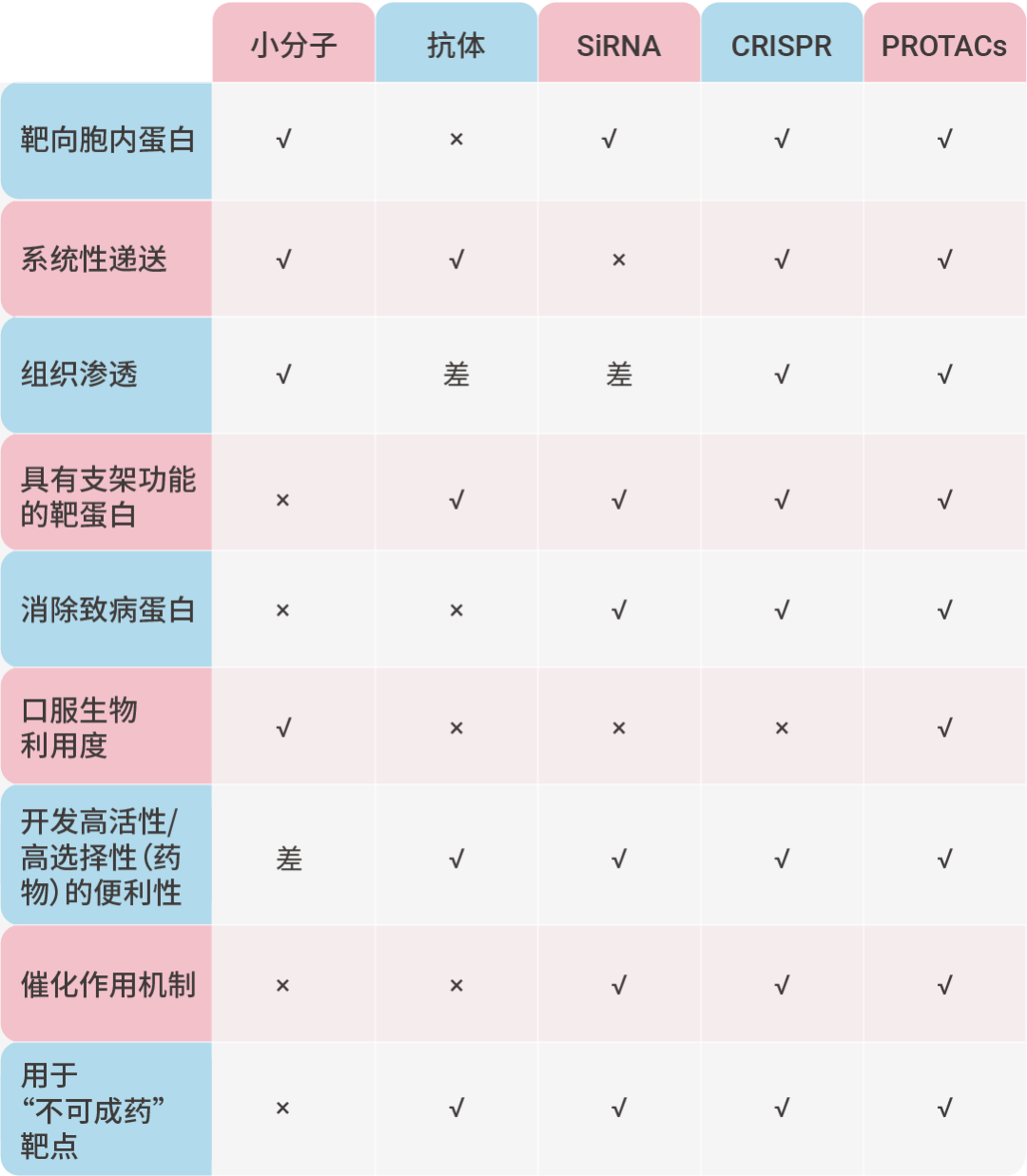
Section.03 PROTAC 组分的优化策略
靶点选择与配体设计 PROTAC 的降解效能并非依赖其与靶蛋白的 "强力绑定",而是取决于其促成靶蛋白-E3 连接酶三元复合物形成的效率。 研究表明,以 Foretinib 为配体的 PROTAC 虽与靶激酶结合紧密,却因三元复合物组装效率低下导至降解范围受限。此外,过高的结合亲和力或共价作用可能导至 PROTAC 与靶蛋白形成 "分子级死锁",阻碍其从降解复合物中解离并参与下一轮催化循环,这种不可逆结合模式反而削弱了 PROTAC 的核心优势,使其退化为类似传统抑制剂的 "单次作用剂"。 目前虽无类似“类药五原则"的普适标准,但理想靶蛋白应具备[4]: ① 致病性功能获得 (如过表达、突变或定位异常,如致癌蛋白BRD4); ② 存在配体结合口袋 (即使亲和力较低,如 KRAS G12D 突变体); ③ 表面存在可泛素化位点 (便于 E3 连接酶标记降解); ④ 含蛋白酶体易处理的柔性区域 (如无序结构域)。
E3 泛素连接酶选择 E3 连接酶可以说是 PROTAC 疗效的隐形操盘手,比如靶向 KRAS (G12C) 突变体的 PROTAC,使用 CRBN 的配体完全无效,而改用 VHL 的 PROTAC 却能高效降解! 综合来说,E3 类型、配体结构、连接链设计、靶蛋白大小及亚细胞定位等共同决定成败。 除了 CRBN、VHL 等经典角色之外,E3 连接酶家族正迎来一批潜力新秀——RNF4、RNF114、KEAP1、FEM1B,它们如同细胞内的 "蛋白清洁工",可被 PROTAC 激活后精准标记并清除致病蛋白。 得益于 AlphaFold 的 AI 技术,科学家们正以极高的效率破解 E3 的 3D 结构,将靶点库从个位数扩容至 200+,甚至为特定肿瘤定制导航武器:例如利用肝癌中高表达的 KEAP1 设计 "肿瘤定位导弹"。然而,挑战依然艰巨——部分 E3 像加密保险箱 (如 VHL 需特定信号激活),解锁难度拉满。
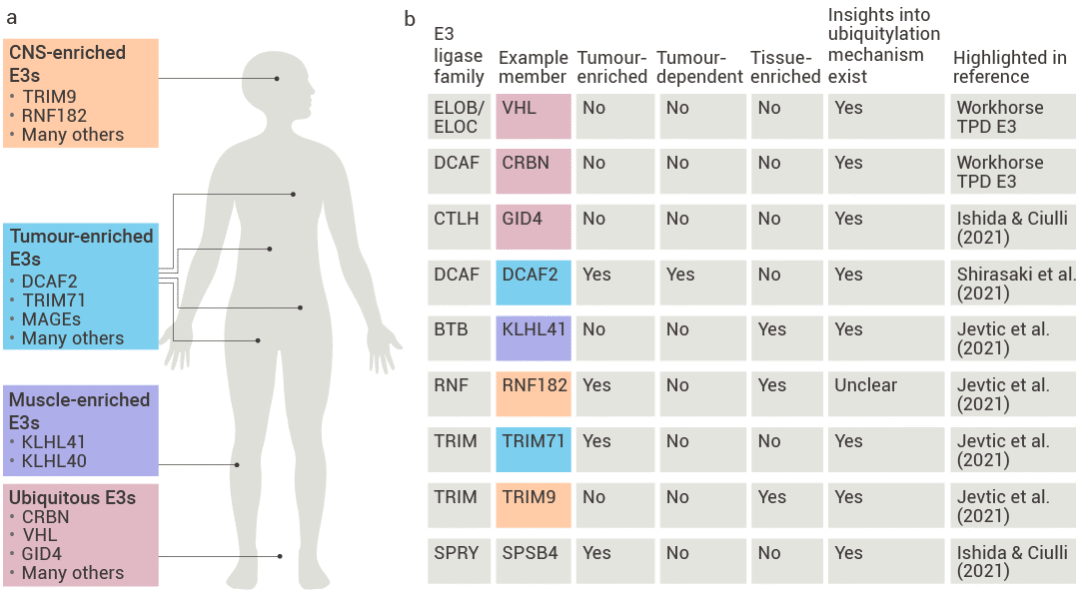 图 4. 用于潜在 PROTAC 应用的专用 E3 连接酶[6]。
连接子的选择[7][8] 连接子长度通常设计在 10-20 个原子的 "黄金区间" ——最新研究揭示其与降解活性呈特征性 L 型关系:过短时,靶蛋白与 E3 连接酶如同 "拥挤电梯" 般发生空间碰撞;过长时,分子链的熵效应又会让两者 "形同陌路",二者皆导至降解效力断崖式下降。因此,PROTAC 开发常以稍长连接子为起点,通过 "毫米级" 原子增减进行精细校准。这段纳米尺度的 "分子铰链" 不仅调控着靶蛋白结合口袋的精准对接,更通过疏水性、电荷分布等参数,暗中支配整个分子的溶解性、膜穿透性等关键性质,堪称降解剂设计中 "牵一发而动全身" 的核心变量。不同连接子的结构和特征可参考过往推文“PROTAC——模块化构建药物分子的未来”。
Section.04 PROTACs 的临床现状
PROTACs 的治疗潜力正迅速转化为临床应用,目前已有多个候选药物进入临床试验阶段,用于靶向治疗癌症、自身免疫性疾病和神经退行性疾病。其中大多数采用口服给药方式,并利用基于 CRBN 的 E3 连接酶招募策略。
处于临床试验阶段的代表性 PROTACs[9][10]。 上下滑动查看更多
PROTAC 技术挑战:钩状效应 在超过其最大活性浓度时,两种化合物都表现出一种靶标降解减弱的现象,这种现象被称为“钩状效应”。 PROTAC 介导的三元复合物形成遵循钟形浓度响应曲线:高浓度时 (1-10 μM),非功能性二元复合物 (PROTAC-靶蛋白或 PROTAC-E3 连接酶) 竞争性抑制功能性三元复合物 (靶蛋白-PROTAC-E3 连接酶),导至降解效率下降。 研究表明,增强蛋白互作 (PPI) 正协同性可缓解此现象:BTK 靶向 PROTAC MT-802 通过稳定三元复合物,在 2.5 μM 以下浓度未观测到钩状效应。大环化策略创新性利用构象限制强化协同结合,使三元复合物能量上更占优——相较于线性类似物 MZ1,大环 PROTAC 展现出更强的降解效力与靶标选择性。这说明三元复合物的识别机制对 PROTAC 设计非常重要,需要结合结构生物学等方法进一步研究[13][14]。
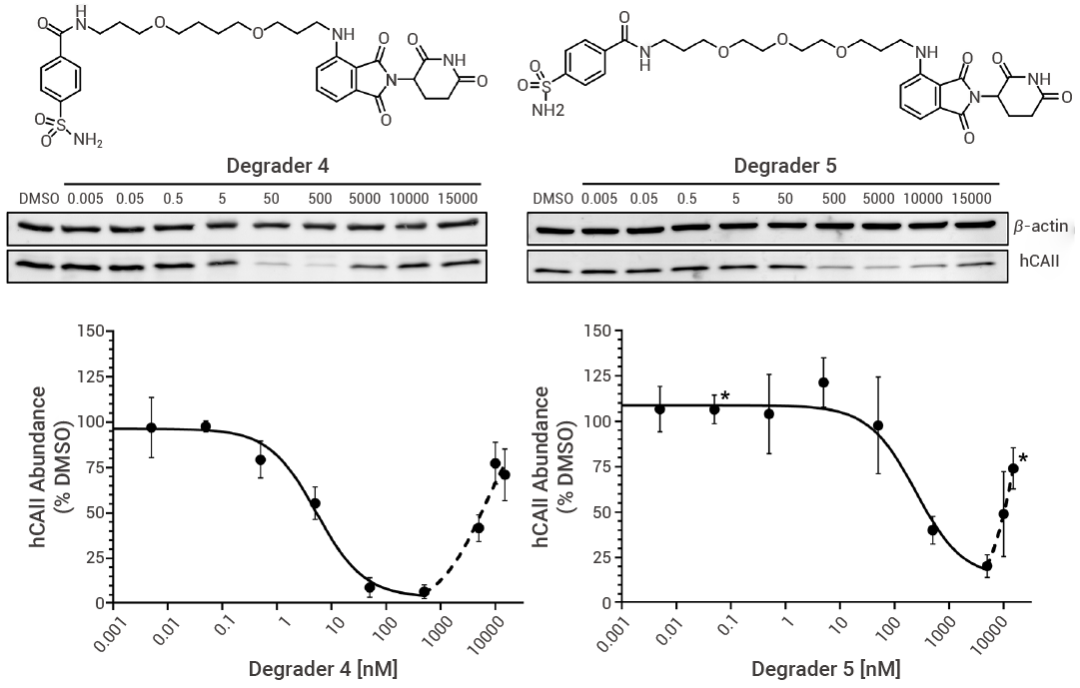 图 5. 降解剂 4 与 5 对 hCAII 的剂量依赖性降解作用[14]。
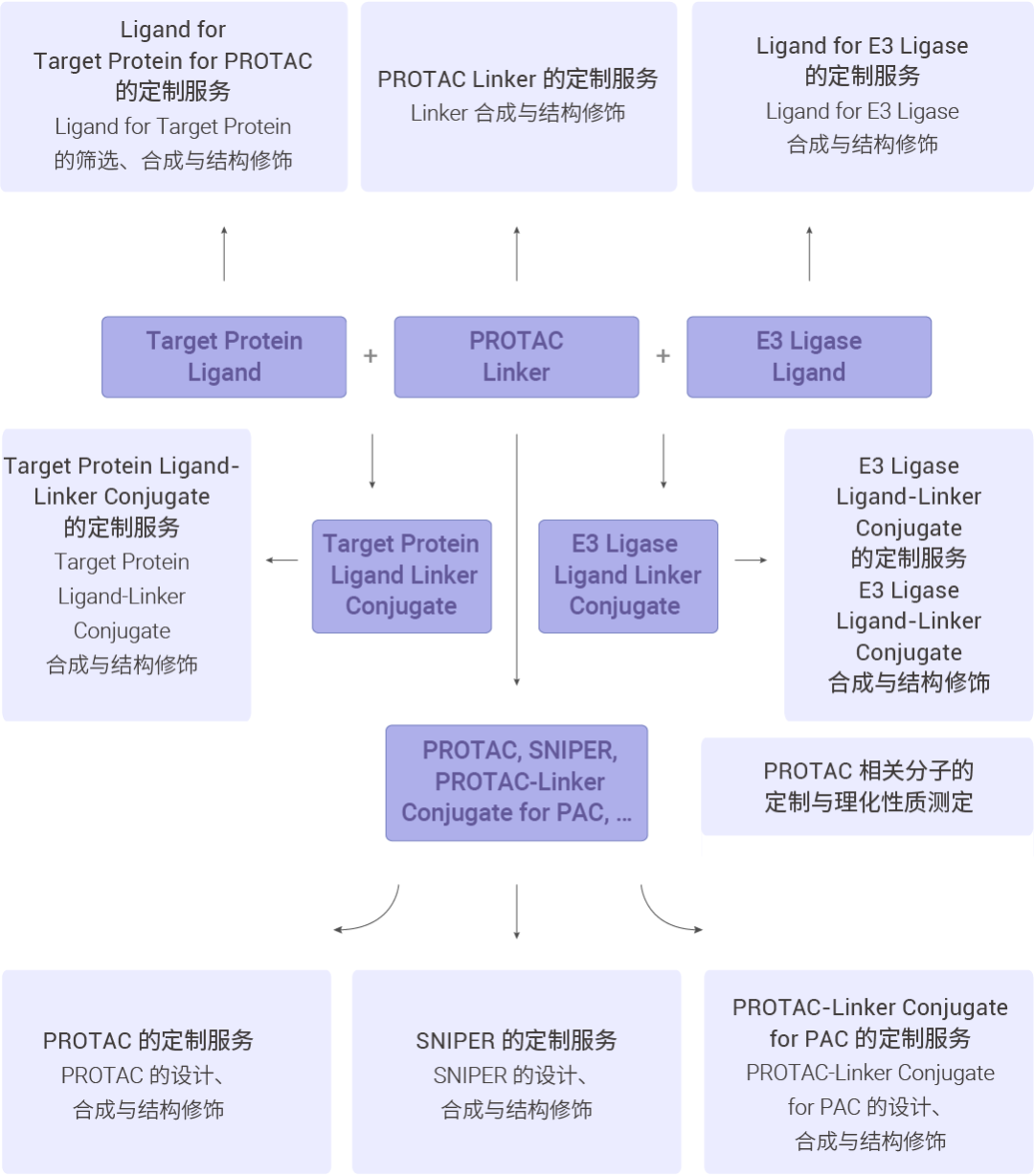
MCE 的一体化 PROTAC 平台 MCE 能够提供 PROTAC 相关产品 (Ligand for E3 Ligase; PROTAC Linker; Ligand for Target Protein for PROTAC; E3 Ligase Ligand-Linker Conjugate; Target Protein Ligand-Linker Conjugate; PROTAC; SNIPER; PROTAC-Linker Conjugate for PAC) 的设计、合成、分析、纯化、优化、检测和评估等一站式服务。
 
|  /3
/3 