登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
CNS 不是梦! 科研大佬用 MCE 产品发表 Nature,我也在用 MCE 产品,四舍五入,我距离发 CNS 又近了一大步! 科研大佬用 MCE 产品发表 Nature,我也在用 MCE 产品,四舍五入,我距离发 CNS 又近了一大步!  喜报!恭喜我们的客户使用 MCE 产品在 Nature 发表创新性研究~本文要和大家分享的是近期发表在 Nature 的客户文献: “FBP1 controls liver cancer evolution from senescent MASH hepatocytes” (FBP1 控制衰老的 MASH 肝细胞的肝癌进化)[1]。该文献使用了 Etoposide (HY-13629)、5-azacytidine (HY-10586)、BpV (HOpic) (HY-128693)、NK252 (HY-19734) 进行研究,其中 Etoposide、5-azacytidine 常用于诱导细胞自噬,BpV 是 PTEN 抑制剂,NK-252 是一种有效的的 Nrf2 激活剂。 喜报!恭喜我们的客户使用 MCE 产品在 Nature 发表创新性研究~本文要和大家分享的是近期发表在 Nature 的客户文献: “FBP1 controls liver cancer evolution from senescent MASH hepatocytes” (FBP1 控制衰老的 MASH 肝细胞的肝癌进化)[1]。该文献使用了 Etoposide (HY-13629)、5-azacytidine (HY-10586)、BpV (HOpic) (HY-128693)、NK252 (HY-19734) 进行研究,其中 Etoposide、5-azacytidine 常用于诱导细胞自噬,BpV 是 PTEN 抑制剂,NK-252 是一种有效的的 Nrf2 激活剂。 该研究揭示了 FBP1 在肝癌 (HCC) 发生中的作用,发现其在衰老样 MASH 肝细胞中升高,MASH 中 FBP1 和 p53 抑制肝癌进展,后两者下调则促进。FBP1 缺失通过 AKT 激活促进肝癌发生,NRF2 与 FBP1 相互作用影响肝癌相关过程,包括代谢和细胞周期基因表达等。 该研究揭示了 FBP1 在肝癌 (HCC) 发生中的作用,发现其在衰老样 MASH 肝细胞中升高,MASH 中 FBP1 和 p53 抑制肝癌进展,后两者下调则促进。FBP1 缺失通过 AKT 激活促进肝癌发生,NRF2 与 FBP1 相互作用影响肝癌相关过程,包括代谢和细胞周期基因表达等。
Section.01背景介绍
Nature 子刊 Gastroenterology & Hepatology 发表的一篇综述指出:非酒精性脂肪性肝病 (NAFLD) 全球患病率为 20%~25%。而我国上海、北京等地区的流行病学调查显示,10 年间,普通成人 B 超诊断的非酒精性脂肪肝患病率从 15% 增加到 31% 以上,也就是说,每三个人中就有一个是脂肪肝。NAFLD 影响了全球多达三分之一的人口,且已成为肝硬化、肝衰竭和肝癌发病率快速增长的主要原因[1][2]。代谢功能障碍相关脂肪性肝炎 (MASH) 是脂肪性肝病常见的炎症并发症,尽管 MASH 能够触发肝细胞衰老死亡,但这种状态却同时增加了 HCC 的风险。MASH 是如何在增加肝细胞癌风险的同时又抑制肝细胞癌的发生?
Section.02研究方法与发现人类 HCC 中的 p53 和 FBP1 表达下降 研究人员发现,FBP1 (果糖-1,6-二磷酸酶 1) 在调控肝细胞衰老和 HCC 发展中扮演着至关重要的角色。正常情况下,FBP1 有助于失活促癌酶 AKT,并维持 TP53 (一种重要的肿瘤抑制蛋白) 的水平。当 FBP1 表达减少时,AKT 被激活,加速了 TP53 的降解,并稳定了促癌转录因子 NRF2,从而促进了癌症的发展 (图 1)。
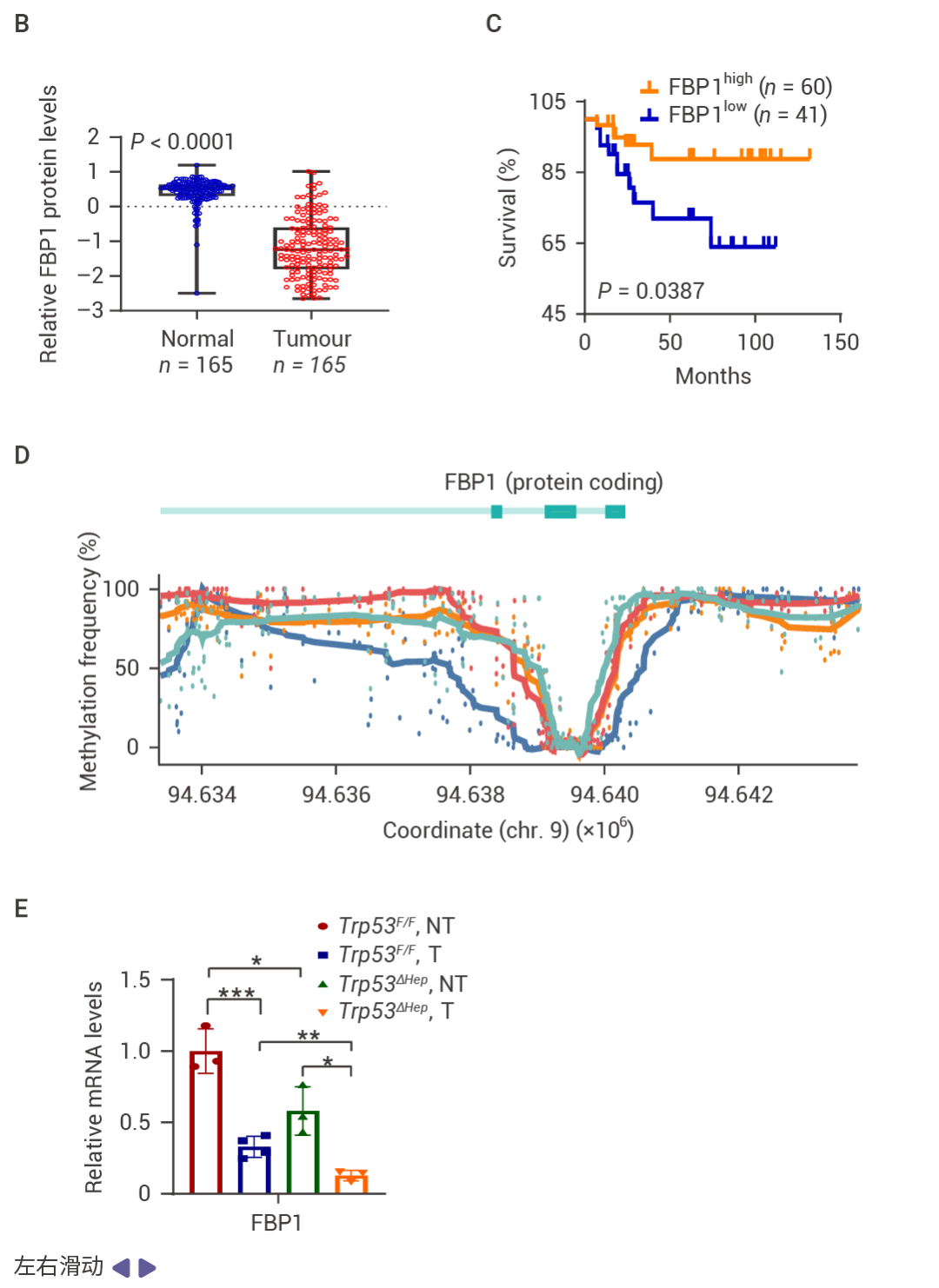 图 1. FBP1 和 P53 在人类 HCC 中表达下调。 在 83 例 HCC 中,71% 的病例中 FBP1 表达下调,并且与 ALDOB 丢失、AKT 激活、MDM2 Ser166 (AKT 位点) 磷酸化升高以及 p53、p21CIP1 和 p16INK4a 表达下降显著相关 (图 1a)。在 HCC 中,FBP1 广泛下调 (图 1b)。低 FBP1 和 ALDOB 表达与较差的生存率相关 (图 1c)。甲基化组分析显示,与正常肝细胞核相比,HCC 细胞核中 FBP1 启动子区域的高甲基化水平,而 TP53 启动子的甲基化未见改变 (图 1d)。TP53 缺失降低了小鼠肝脏、致癌物诱导的 HCC、人类肝细胞以及 TP53 野生型 HCC 细胞系 HepG2 和 SK-Hep-1 中 FBP1 的 mRNA 和蛋白水平 (图 1e)。 MASH 提高的 FBP1 和 p53 抑制 HCC 尽管肝细胞衰老被认为是推动 MASH 和纤维化的因素,但敲除衰老细胞中的 FBP1 会增加肝纤维化、肝脂肪变性、肝脏和血脂,并抑制糖原积累和胰岛素抵抗。肝细胞衰老先于 MASLD/MASH,但它抑制了纤维化和 HCC 的进展,Trp53ΔHep 小鼠脂肪肝炎的升高也表明了这一点。DNA 损伤诱导的 FBP1 和 p53 在 MASH 中显著上调,提示其在 MASH 病理过程中可能发挥重要作用 (图 2)。 图 2. DNA 损伤诱导的 FBP1 和 p53 在 MASH 中的上调。 喂食易感 MASH 的 MUP-uPA 小鼠高果糖饮食 (HFrD),而非等热量的玉米淀粉饮食 (CSD),诱导了 p53、p21CIP1、p16INK4a 和 FBP1 的表达,并抑制了 AKT 激活 (图 2a)。肝细胞 DNA 损伤及其 DNA 损伤反应 (DDR) 介质升高,同时观察到 P-RPA2 和衰老相关的 β-半乳糖苷酶表达升高 (图 2b)。HFrD 饲喂诱导了早期癌前病变,这些病变中聚泛素化蛋白聚集体和自噬伴侣蛋白 p62 的积累提示自噬受损,NRF2 (NQO1)、CD44 和 MYC 被激活,而 p53 和 FBP1 表达下调 (图 2c)。晚期人类 MASH 蛋白质组和组织的分析证实了 FBP1、ALDOB、p53、p21CIP1、p16INK4a 和 DDR 的上调,以及 AKT 和 NRF2 活性的降低 (图 2d)。FBP1 的缺失增加了 HcPC 的数量,而 HcPC 比未聚集的肝细胞表现出更多的 DNA 损伤,同时伴随着 DDR 和 DNMT1 的上调、AKT 和 NRF2 的激活,以及 FBP1、p53、p21CIP1 和 p16INK4a 的下调 (图 2e)。单核 RNA 测序表明 FBP1 缺失增加了疾病相关肝细胞的数量,同时减少了 3 区肝细胞 (图 2f)。WB 结果表明 FBP1 缺失缓解了 HFrD 诱导的 AKT 抑制,增强了 GSK3β Ser9 和 MDM2 Ser166 的磷酸化、DDR 标志物的表达,并下调了 p53 和 p21CIP1 (图 2g)。 FBP1 的缺失通过 AKT 激活促进肿瘤发生 研究表明 FBP1 或 p53 的缺失以及 AKT 的激活均能促进 NRASG12V 驱动的肿瘤发生,而通过恢复 FBP1 功能或抑制 AKT 信号通路可以显著抑制肿瘤的发生和发展 (图 3)。 图 3. FBP1 或 p53 缺失以及 AKT 激活促进 NRASG12V 肿瘤发生。 NRASG12V 在 Fbp1F/F 小鼠中几乎不具肿瘤形成能力,但在 Fbp1ΔHep 小鼠中,它迅速诱导轻度纤维化的 HCC,这些肿瘤阳性表达 α-胎蛋白 (AFP)、CD44 和 MYC (图 3a, b)。与 NRF2 激活一致,p53 和 p21 表达下调 (图 3c)。肝细胞 Trp53 缺失同样支持了快速的 NRASG12V 诱导的 HCC,同时下调 FBP1 并增强 AKT 和 NRF2 的激活 (图 3d)。在 Fbp1F/F 和 Fbp1ΔHep 小鼠肝脏中转导了 AAV8-Ctrl、AAV8-FBP1 和 AAV8-FBP1(E98A),两者均显著减少了肿瘤数量和体积 (图 3e)。AKT 抑制剂 (AKTi) 和 nutlin-3a 也阻止了 NRASG12V 诱导的 HCC,nutlin-3a 不影响 AKT 或 NRF2,而 AKTi 阻断了 NRF2 的激活、AKT 和 GSK3β 的磷酸化以及 MDM2 的磷酸化,同时恢复了 p53 和 p21CIP1 的表达 (图 3f–h)。 相互调控的 NRF2–FBP1 交互作用 实验结果表明 HCC 细胞中 FBP1 的敲除激活了 NRF2。相反,FBP1 过表达抑制了 GSK3βSer9 磷酸化,并降低了 NRF2 WT 和 NRF2 (E79Q) 的表达。NRF2 的激活导至了显著的肝细胞增殖标记的上升,而这种变化与肿瘤发生和发展的标志密切相关。实验还分析了 NRF2 诱导的 FBP1 降解可能是通过一种依赖于 ERK 磷酸化的途径实现的,证明了 NRF2 通过诱导特异性生长因子,进而活化 ERK 通路,从而促进了 FBP1 的降解。这一机制表明,NRF2 可能通过降解 FBP1 这样的肿瘤抑制因子来解除对细胞增殖和肿瘤发展过程的制约 (图 4)。
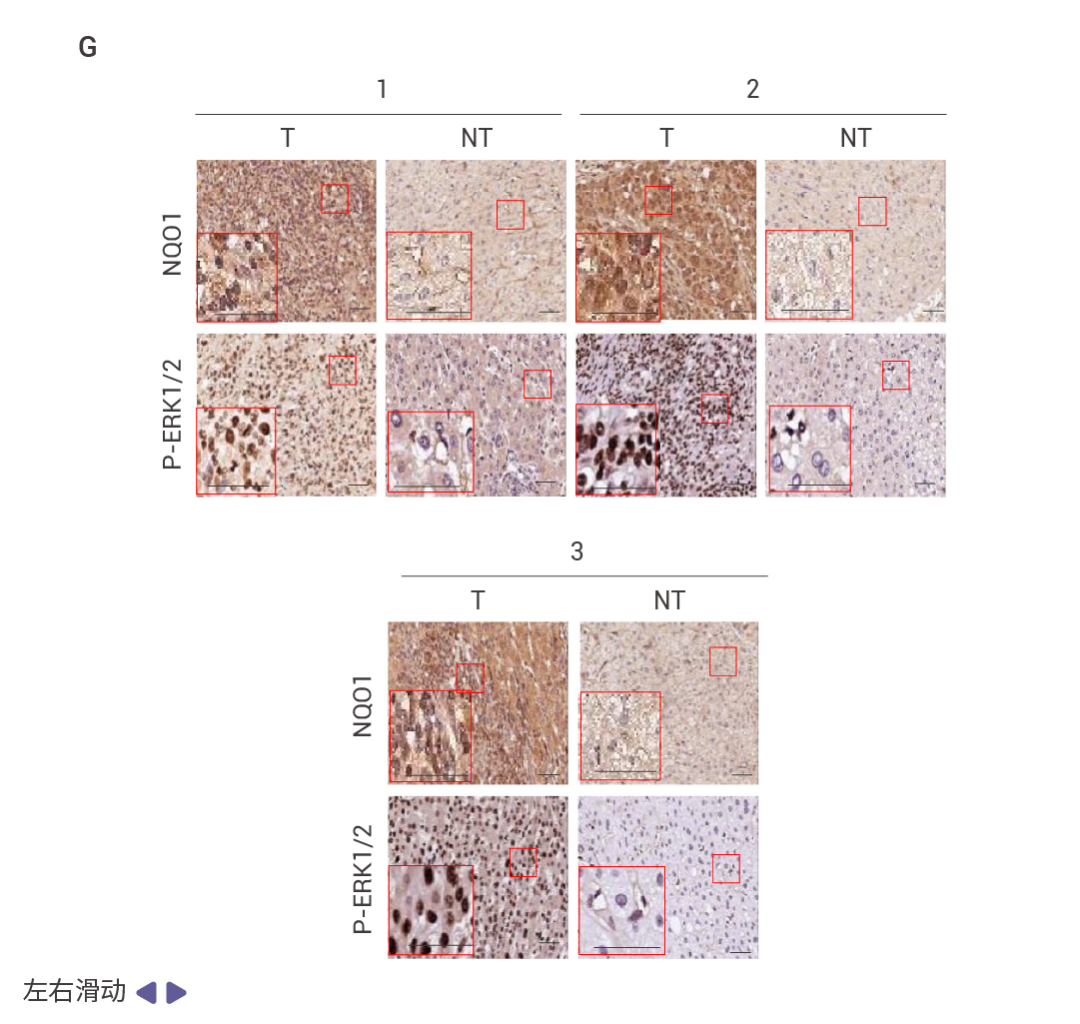 图 4. NRF2 诱导的 FBP1 降解缓解衰老以激发肿瘤形成。 HCC 细胞中 FBP1 缺失激活了 NRF2 (图 4a)。在 Nrf2Act-Hep 小鼠中特异性表达 NRF2 (E79Q) 会下调 FBP1 和 p53 (图 4b)。ATG7 缺失通过 p62 积累激活 NRF2 并增强 HCC 发展,这导至了更为显著的 FBP1 下调 (图 4c)。HCC 细胞中表达 NRF2 (E79Q) 加速了 FBP1 的周转 (图 4d),FBP1 有两个潜在的 ERK 磷酸化受体,包括 Ser271,其中用丙氨酸替换可阻止 ERK 诱导的磷酸化及其与 FBP1 相关的泛素连接酶 TRIM28 的招募 (图 4e)。ERK2 沉默可阻止 TRIM28 诱导的 FBP1 泛素化,而磷酸模拟突变 S271D 则增强了这一过程 (图 4f)。FBP1 低表达的人类 HCC 还显示出 NRF2、NQO1 和 ERK 磷酸化的上调 (图 4g)。 NRF2–FBP1 的逆转录组调控 RNA-seq 分析显示,在 Fbp1ΔHep 与 Fbp1F/F 小鼠肝脏中上调的差异表达基因中,有超过三分之一是 NRF2 诱导的,包括支持细胞增殖的脂肪酸、硫化合物、小分子、核苷、核苷酸、核糖核苷酸和氨基酸代谢相关基因。在 FBP1 缺失后下调的差异表达基因中,有四分之一与核糖核蛋白生成、非编码 RNA 和 mRNA 代谢、肌动蛋白丝组织、细胞衰老、p53 信号传导和凋亡调控相关,这些基因也在 Nrf2Act-Hep 小鼠肝脏中被抑制。在对照肝脏中,NRASG12V 诱导了与衰老相关的 p53 调控基因,并抑制了细胞周期基因。人类 CPTAC 数据库显示了类似的 FBP1 对细胞衰老和细胞周期蛋白的影响,证实了 NRF2 和 FBP1 逆向调控了一种与代谢重编程相关的抗衰老程序。
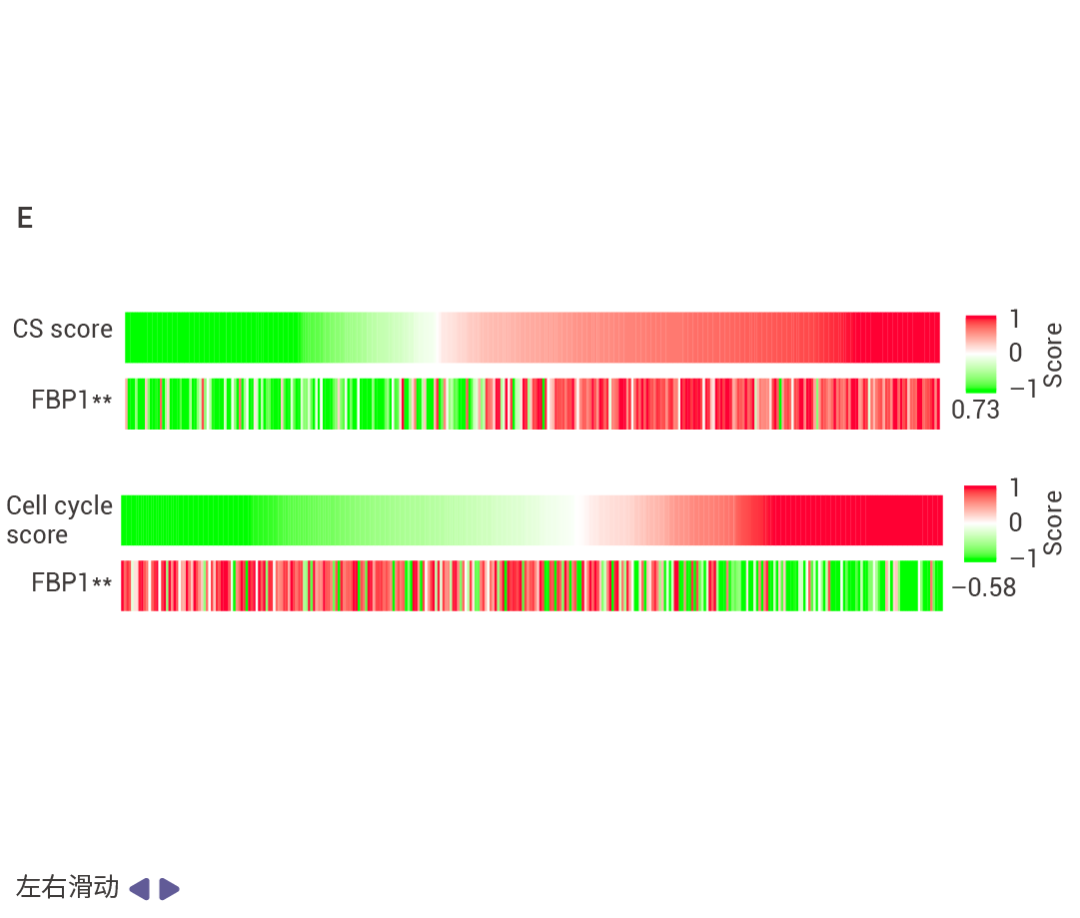 图 5. NRF2 和 FBP1 逆向影响肝细胞转录组。 Nrf2Act-Hep 与 Nrf2Tg/Tg、Fbp1ΔHep 与 Fbp1F/F 肝脏重叠上调基因的基因本体生物学过程 (GO BP) 富集分析结果 (图 5a)。Nrf2Act-Hep 与 Nrf2Tg/Tg 和 Fbp1ΔHep 与 Fbp1F/F 肝脏重叠下调基因的基因本体生物学过程富集分析 (图 5b)。对照或 NRASG12V 流体动力学尾静脉注射 (HTVI) 1 周后 Nrf2Tg/Tg 和 Nrf2Act-Hep 肝脏细胞衰老 mRNA 的热图数据 (图 5c,d)。CPTAC-LIHC 数据中 FBP1 蛋白的细胞衰老 (CS) (上) 和细胞周期 (下) 评分。(图 5e)。 NRF2 和 FBP1 对突变的相反影响 作者发现 HFD 诱导的 MUP-uPA-HCCs 含有体细胞突变。HFrD 和 HFD 诱导的 MUP-uPA-Fbp1ΔHep-HCC 的双重测序显示每个肿瘤平均有 500 个单碱基替换和 100 个小插入和缺失 (indel),突变模式富集了 C>T 转换,特别是在 HFrD 诱导的 HCC 中。NRASG12V 转导的 Nrf2Act-Hep 和 Nrf2Tg/Tg 肝脏和肿瘤的全基因组测序表明,对照肝脏几乎不含任何突变,而 NRF2 激活的肿瘤有 1,000-2,000 个替换和 10-20 个 indels。这与人类肝细胞癌的突变模式相似。实验结果表明,在 NRASG12V 引导下,染色体损伤触发肝细胞衰老后,若对其施以促进 AKT 和 NRF2 通路激活的处理,这些衰老细胞会重新进入细胞周期并转化为肿瘤。此外,绿色荧光信号主要集中在肿瘤区域,这表明衰老细胞是 HCC 发生的来源。
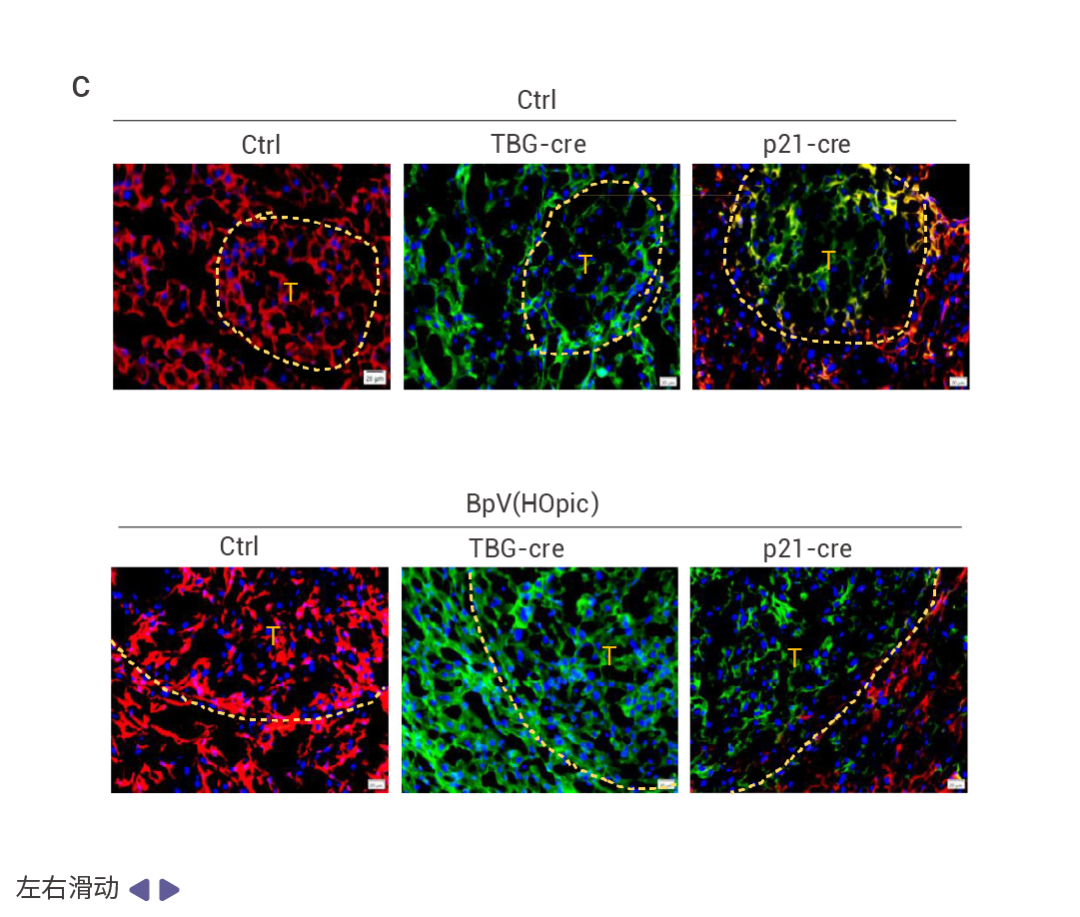 图 6. 突变特征和 HCC 从 DNA 损伤和衰老前驱细胞中出现的过程。 基于 hfrd 诱导的 MUP-uPA Fbp1ΔHep HCC 的三核苷酸的突变频率特征 (图 6a)。NRASG12V 诱导的 Nrf2Act-Hep HCC 的突变频率特征 (图 6b)。冷冻 mT/mG 肝脏切片 DAPI 染色结果 (图 6c)。
Section.03小结
MASH 是如何在增加肝细胞癌风险的同时又抑制肝细胞癌的发生?该研究表明,MASH 增加了肝癌的风险,同时触发肿瘤抑制的肝细胞衰老。通过详细的组织学、蛋白质组学和转录组学分析,研究发现 MASH 肝细胞高表达 FBP1、p53 和关键衰老标志物,而与之相对的疾病相关肝细胞 (daHeps)、HCC 前体细胞 (HcPCs) 和确立的 HCC 则表现出 FBP1 和 p53 下调。这种下调可能是由于在代谢压力的 HCC 前体中 NRF2 激活所致。研究揭示了 NRF2 通过诱导 ERK 活化的生长因子触发 FBP1 的磷酸化依赖性降解,解除 AKT 活化的抑制,加速 p53 降解和衰老逆转。这些调节相互作用倾向于促进 HcPCs 扩增,使 DNA 损伤诱导的突变得以传播并导至肿瘤发生。研究强调了 NRF2 和 AKT 激活或 FBP1 缺失在肝细胞衰老和肝癌进展中的重要作用,并为开发有效的 DNA 损伤抑制剂以用于 MASH 和 HCC 的预防提供了理论支持。产品推荐 | | EtoposideEtoposide (VP-16; VP-16-213) (HY-13629),是一种常用的抗肿瘤化疗剂。Etoposide 抑制拓扑异构酶 II (topoisomerase-II),诱导细胞周期停滞,凋亡 (apoptosis) 和自噬 (autophagy)。 | | 5-Azacytidine5-Azacytidine (Azacitidine; 5-AzaC; Ladakamycin) (HY-10586),是胞苷核苷类似物,特异型抑制 DNA 甲基化。5-Azacytidine 诱导细胞自噬 (autophagy)。 | | BpV (HOpic)BpV (HOpic) (HY-128693),是一种有效的和选择性的 PTEN 抑制剂,IC50 值为 14 nM。Nanocarrier-BpV (HOpic) 具有神经保护作用。 | | NK252NK-252 (HY-19734),是一种潜在的 Nrf2 激活剂,具有很好的 Nrf2 活化能力。 |
 [1] Gu, L., Zhu, Y., Nandi, S.P. et al. FBP1 controls liver cancer evolution from senescent MASH hepatocytes. Nature 637, 461–469 (2025). [2] Huang DQ, et al. Global epidemiology of NAFLD-related HCC: trends, predictions, risk factors and prevention. Nat Rev Gastroenterol Hepatol. 2021 April ; 18(4): 223–238.
|  /3
/3 