登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
一、GST pull-down实验
基本原理:将靶蛋白-GST融合蛋白亲和固化在谷胱甘肽亲和树脂上,作为与目的蛋白亲和的支撑物,充当一种“诱饵蛋白”,目的蛋白溶液过柱,可从中捕获与之相互作用的“捕获蛋白”(目的蛋白),洗脱结合物后通过SDS-PAGE电泳分析,从而证实两种蛋白间的相互作用或筛选相应的目的蛋白,“诱饵蛋白”和“捕获蛋白”均可通过细胞裂解物、纯化的蛋白、表达系统以及体外转录翻译系统等方法获得。此方法简单易行,操作方便。注:GST即谷胱甘肽巯基转移酶(glutathione S-transferase) 二、足印法(Footprinting) 足印法(Footprinting)是一种用来测定DNA-蛋白质专一性结合的方法,用于检测目的DNA序列与特定蛋白质的结合,也可展示蛋白质因子同特定DNA片段之间的结合。其原理为:DNA和蛋白质结合后,DNA与蛋白的结合区域不能被DNase(脱氧核糖核酸酶)分解,在对目的DNA序列进行检测时便出现了一段无DNA序列的空白区(即蛋白质结合区),从而了解与蛋白质结合部位的核苷酸数目及其核苷酸序列。 三、染色质免疫共沉淀技术(Chromatin Immunoprecipitation,ChIP) 染色质免疫共沉淀技术(Chromatin Immunoprecipitation,ChIP)是研究体内蛋白质与DNA相互作用的有力工具,利用该技术不仅可以检测体内反式因子与DNA的动态作用,还可以用来研究组蛋白的各种共价修饰以及转录因子与基因表达的关系。 染色质免疫沉淀技术的原理是:在生理状态下把细胞内的DNA与蛋白质交联在一起,通过超声或酶处理将染色质切为小片段后,利用抗原抗体的特异性识别 反应,将与目的蛋白相结合的DNA片段沉淀下来。染色质免疫沉淀技术一般包括细胞固定,染色质断裂,染色质免疫沉淀,交联反应的逆转,DNA的纯化及鉴定。 四、基因芯片(又称 DNA 芯片、生物芯片)技术 基因芯片指将大量探针分子固定于支持物上后与标记的样品分子进行杂交,通过检测每个探针分子的杂交信号强度进而获取样品分子的数量和序列信息。通俗地说,就是通过微加工技术 ,将数以万计、乃至百万计的特定序列的DNA片段(基因探针),有规律地排列固定于2cm2 的硅片、玻片等支持物上,构成的一个二维DNA探针阵列,被称为基因芯片。基因芯片主要用于基因检测工作 。 基因芯片的测序原理是杂交测序方法,即通过与一组已知序列的核酸探针杂交进行核酸序列测定的方法,在一块基片表面固定了序列已知的八核苷酸的探针。当溶液中带有荧光标记的核酸序列TATGCAATCTAG,与基因芯片上对应位置的核酸探针产生互补匹配时,通过确定荧光强度最强的探针位置,获得一组序列完全互补的探针序列。据此可重组出靶核酸的序列。 五、高效液相色谱(HPLC) 高效液相色谱法是在经典色谱法的基础上,引用了气相色谱的理论,在技术上,流动相改为高压输送;色谱柱是以特殊的方法用小粒径的填料填充而成,从而使柱效大大高于经典液相色谱(每米塔板数可达几万或几十万);同时柱后连有高灵敏度的检测器,可对流出物进行连续检测。 高压泵将贮液罐的流动相经进样器送入色谱柱中,然后从检测器的出口流出,这时整个系统就被流动相充满。当欲分离样品从进样器进入时,流经进样器的流动相将其带入色谱柱中进行分离,分离后不同组分依先后顺序进入检测器,记录仪将进入检测器的信号记录下来,得到液相色谱图。 六、酵母双杂交(Y2H) 七、噬菌体展示技术 噬菌体展示技术是将外源蛋白或多肽的DNA序列插入到噬菌体外壳蛋白结构基因的适当位置,使外源基因随外壳蛋白的表达而表达,同时,外源蛋白随噬菌体的重新组装而展示到噬菌体表面的生物技术。 噬菌体展示技术是将多肽或蛋白质的编码基因或目的基因片段克隆入噬菌体外壳蛋白结构基因的适当位置,在阅读框正确且不影响其他外壳蛋白正常功能的情况下,使外源多肽或蛋白与外壳蛋白融合表达,融合蛋白随子代噬菌体的重新组装而展示在噬菌体表面。被展示的多肽或蛋白可以保持相对独立的空间结构和生物活性,以利于靶分子的识别和结合。肽库与固相上的靶蛋白分子经过一定时间孵育后,洗去未结合的游离噬菌体,然后以竞争受体或酸洗脱下与靶分子结合吸附的噬菌体,洗脱的噬菌体感染宿主细胞后经繁殖扩增,进行下一轮洗脱,经过3轮~5轮的“吸附-洗脱-扩增”后,与靶分子特异结合的噬菌体得到高度富集。所得的噬菌体制剂可用来做进一步富集有期望结合特性的目标噬菌体。 八、RNA提取(Trizol法) Trizol试剂中的主要成分为异硫氰酸胍和苯酚,其中异硫氰酸胍可裂解细胞,促使核蛋白体的解离,使RNA与蛋白质分离,并将RNA释放到溶液中。当加入氯仿时,它可抽提酸性的苯酚,而酸性苯酚可促使RNA进入水相,离心后可形成水相层和有机层,这样RNA与仍留在有机相中的蛋白质和DNA分离开。水相层(无色)主要为RNA,有机层(黄色)主要为DNA和蛋白质。 九、RT-PCR RT-PCR是将RNA的反转录(RT)和cDNA的聚合酶链式扩增(PCR)相结合的技术。首先经反转录酶的作用从RNA合成 cDNA,再以cDNA为模板,扩增合成目的片段。RT-PCR可以一步法或两步法的形式进行。在两步法RT-PCR中,每一步都在最佳条件下进行。 实验步骤: 1、RNA的提取; 2、反转录合成cDNA; 3、PCR扩增; 4、产物的电泳和结果的测定。 十、实时荧光定量PCR(Q—PCR)(Real-time Quantitative PCR ) 利用荧光信号的变化实时检测PCR扩增反应中每一个循环扩增产物量的变化,通过Ct值和标准曲线的关系对起始模板进行定量分析。 阈值:是循环开始3~15个循环的荧光信号的标准偏差的10倍,设定在扩增曲线指数增长期。 C(t)值:荧光信号(扩增产物)到达阈值时所经过的扩增循环次数。 十一、BCA法测蛋白质浓度 十二、大肠杆菌感受态细胞(E.coli DH5α)制备 1、前夜接种受体菌(DH5或DH10B),挑取单菌落于LB培养基中37℃摇床培养过夜(约16小时); 2、取1ml过夜培养物转接于100ml LB培养基中,在37℃摇床上剧烈振荡培养约2.5-3小时(250-300rpm); 3、将0.1M CaCl2溶液置于冰上预冷;以下步骤需在超净工作台和冰上操作; 4、吸取1.5ml培养好的菌液至1.5ml离心管中,在冰上冷却10分钟; 5、4℃下3000 g冷冻离心5分钟; 6、弃去上清,加入100微升预冷0.1M CaCl2溶液,用移液枪轻轻上下吸动打匀,使细胞重新悬浮,在冰放置20分钟; 7 、4℃下3000 g冷冻离心5分钟; 8 、弃去上清,加入100微升预冷0.1M CaCl2溶液,用移液枪轻轻上下吸动打匀,使细胞重新悬浮; 9 、细胞悬浮液可立即用于转化实验或添加冷冻保护剂(15% - 20%甘油)后超低温冷冻贮存备用(-70℃)。 十三、碱变性提取质粒DNA 碱变性提取质粒DNA是基于染色体DNA与质粒DNA的变性与复性的差异而达到分离目的。在pH高达12.6的碱性条件下,染色体DNA的氢键断裂,双螺旋结构解开而变性。质粒DNA的大部分氢键也断裂,但超螺旋共价闭合环状的两条互补链不会完全分离,当以pH4.8的NaAc高盐缓冲液去调节其pH至中性时,变性的质粒DNA又恢复原来的构型,保存在溶液中,而染色体DNA不能复性而形成缠连的网状结构,通过离心,染色体DNA与不稳定的大分子RNA、蛋白质-SDS复合物等一起沉淀下来而被除去。 十四、目的基因的连接、转化及克隆筛选 (1)总过程: 分---PCR分离目的基因 切---限制性内切酶切割 接---目的基因与载体相连 转---转入宿主细胞 筛---筛选阳性重组体 (2)分---PCR分离目的基因:PCR克隆、同源克隆、文库筛选 (3)切---限制性内切酶切割:粘性末端、平末端 (4)接---目的基因与载体相连 原 理:利用DNA聚合酶反应时都有在PCR产物的3’末端添加一个或者几个A碱基的特性和利用T载体3’末端的T碱基和PCR产物的A碱基互补配对,经连接酶作用,完成与载体的连接。 (5)转---转入宿主细胞 感受态细胞:经过电击、 CaCl2、 RuCl等化学试剂处理后,细胞膜的通透性发生变化,成为能容许外源 DNA 分子通过时细胞的状态。 (6)筛---筛选阳性重组体 十五、RNA干扰(RNAi) 一些小的双链RNA(siRNA)可以通过促使特定基因的mRNA降解来高效、特异的阻断体内特定基因表达,诱使细胞表现出特定基因缺失的表型,称为RNA干扰(RNAi)。 十六、cDNA 末端快速扩增 (rapid amplification of cDNA ends,RACE)技术 cDNA 末端快速扩增 (rapid amplification of cDNA ends,RACE)技术是一种基于mRNA反转录和 PCR技术建立起来的、以部分的已知区域序列为起点,扩增基因转录本的未知区域,从而获得mRNA(cDNA)完整序列的方法。简单的说就是一种从低丰度转录本中快速增长cDNA5’和cDNA3’末端,进而获得获得全长cDNA简单而有效的方法,该方法具有快捷、方便、高效等优点,可同时获得多个转录本。因此近年来RACE技术已逐渐取代了经典的cDNA文库筛选技术,成为克隆全长cDNA序列的常用手段。 十七、基因文库和cDNA文库的构建(看课本上的) 十八、mRNA差异显示技术(DD-PCR) mRNA差异显示技术是将mRN A逆转录技术和PCR技术相结合的一种RNA指纹图谱技术。每一种细胞(包括同一组织细胞经过不同的处理)都有其特异表达的不同于其他组织细胞的基因谱(有差异基因表达),即特异的RNA指纹图谱。差异基因表达是细胞分化的基础,正是这些基因在细胞中的特异表达与否,决定了生命历程中细胞的发育和分化、细胞周期调节、细胞衰老和凋亡等。mRNA DDR T-PCR 技术正是对组织特异性表达基因进行分离的一种快速而行之有效的方法。 其基本原理是从基因背景相同的2个或几个被比较的细胞系或组织中提取总RNA,逆转录成cDNA ,用不同引物对,进行PCR 扩增,扩增时加入同位素标记的核苷酸。利用测序胶电泳技术分离PCR 产物,经放射自显影即可找到差异表达的基因。 十九、抑制差减杂交 抑制差减杂交技术原理抑制差减杂交技术(SSH)是由Diatchenko等建立的以抑制性PCR和DNA差减杂交方法相结合的方法。其依据的主要技术有两点:(1)消减杂交;(2)抑制PCR。经抑制差减杂交后的cDNA群体不仅富集了差异表达基因(目的基因),而且目的基因间丰度的差异经过均等化作用已基本消除,使消减后的cDNA群体为丰度一致的目的基因群体。 抽提两种不同来源组织的mRNA(tester和driver),反转录成 cDNA,用4碱基识别酶(RsaI)或HaeIII酶切两种cDNA产生平端片段;将testerc DNA分成均等的两份,分别接上dapter1和adapter2两种接头,并与过量的经RsaI消化的driver样本变性后退火杂交。第一次杂交后有4种产物:a是单链testercDNA;b是自身退火的testercDNA双链;c是tester和driver的异源双链;d是drivercDNA。 根据复性动力学原理,丰度高的单链cDNA退火时产生同源杂交速度快于丰度低的单链cDNA,因此第一次杂交使得丰度有差别的cDNA的单链分子的相对含量趋向一致。混合两份杂交样品,同时加入新的变性driver cDNA 进行第二次消减杂交。杂交完全后补平末端,加入合适引物(即adapter1和adapter2的部分特异序列)进行PCR扩增,只有含不同接头的双链DNA分子(e)才可进行指数扩增,扩增产物即为目的片段。利用adapter上的酶切位点可进行克隆、测序等。 二十、蛋白质芯片 二十一、Northern blot 二十二、Southern blot 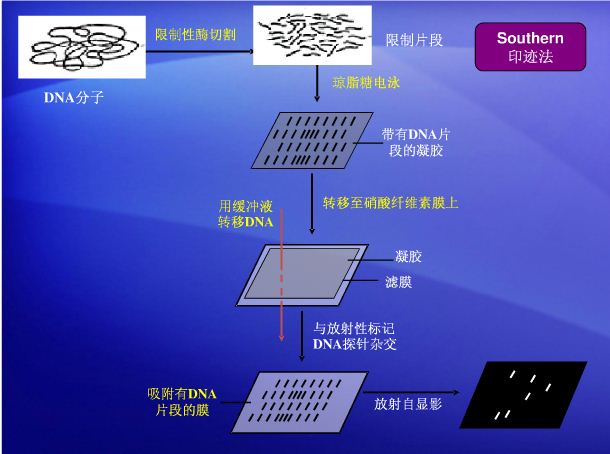
二十三、荧光共振能量转移 二十四、双分子荧光技术 二十五、酶联免疫吸附测定(ELISA) ELISA是一种免疫测定(immunoassay,IA) 。基础:抗原或抗体的固相化及抗原或抗体的酶标记。加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,由此进行定性或定量分析。 二十六、双向凝胶电泳(2-DE) 双向凝胶电泳的原理是第一向基于蛋白质的等电点不同用等电聚焦分离,第二向则按分子量的不同用SDS-PAGE分离,把复杂蛋白混合物中的蛋白质在二维平面上分开。 二十七、mRNA的分离与纯化(寡聚(dT)纤维素柱纯化mRNA) 真核细胞的mRNA分子最显著的结构特征是具有5’端帽子结构(m7G)和3’端的Poly(A)尾巴。绝大多数哺乳类动物细胞mRNA的3’端存在20-30个腺苷酸组成的Poly(A)尾,通常用Poly(A+)表示。这种结构为真核mRNA的提取,提供了极为方便的选择性标志,寡聚(dT)纤维素或寡聚(U)琼脂糖亲合层析分离纯化mRNA的理论基础就在于此。 mRNA的分离方法较多,其中以寡聚(dT)-纤维素柱层析法最为有效,已成为常规方法。此法利用mRNA 3’末端含有Poly(A+)的特点,在RNA流经寡聚(dT)纤维素柱时,在高盐缓冲液的作用下,mRNA被特异地结合在柱上,当逐渐降低盐的浓度时或在低盐溶液和蒸馏水的情况下,mRNA被洗脱,经过两次寡聚(dT)纤维柱后,即可得到较高纯度的mRNA。 二十八、His-tag纯化蛋白 His•Tag序列(6、8或10个连续的组氨酸残基)与固定在基于NTA(氮川三乙酸镍) -和IDA- 的His•Bind树脂上的二价阳离子Ni2+结合。洗去未结合蛋白后,用咪唑或稍低的pH洗脱并回收目标蛋白。该通用系统使得可在温和、非变性条件,或存在6M胍或尿素条件下纯化蛋白。 二十九、RNA酶保护试验方法 (RNase Protection Assay,RPA) RNA酶保护法是近十年发展起来的一种全新的mRNA定量分析方法。其基本原理是将标记的特异RNA探针(32P或生物素)与待测的RNA样品液相杂交,标记的特异RNA探针按碱基互补的原则与目的基因特异性结合,形成双链RNA;未结合的单链RNA经RNA酶A或RNA酶T1消化形成寡核糖核酸,而待测目的基因与特异RNA探针结合后形成双链RNA,免受RNA酶的消化,故该方法命名为RNA酶保护实验。与Northern blot和RT-PCR比较,RPA有以下几个优点:1. 检测灵敏度比Northern杂交高。由于Northern杂交步骤中转膜和洗膜都将造成样品和探针的损失,使灵敏度下降,而RPA将所有杂交体系进行电泳,故损失小,提高了灵敏度。2. 由于PCR扩增过程中效率不均一和反应“平台”问题,基于PCR产物量进行分析所得数据的可靠性将下降,而RPA没有扩增过程,因此,分析的数据真实性较高。3.由于与反义RNA探针杂交的样品RNA仅为该RNA分子的部分片段,因此,部分降解的RNA样品仍可进行分析。4.步骤较少,耗时短。与Northern杂交相比,省去了转膜和洗膜的过程。5. RNA-RNA杂交体稳定性高,无探针自身复性问题,无须封闭。6. 一个杂交体系中可同时进行多个探针杂交,无竞争性问题。7. 检测分子长度可以任意设置,灵活性大。RPA的缺点是需要同位素标记探针。 三十、免疫组化 三十一、各种分子标记技术的比较 限制性片段长度多态性(Restriction fragment length polymorphisms ,RFLP) 可以作为遗传标记,开创了直接应用DNA 多态性的新阶段,是最早应用的分子标记技术 。RFLP 是检测DNA 在限制性内切酶酶切后形成的特定DNA 片段的大小,反映DNA 分子上不同酶切位点的分布情况,因此DNA 序列上的微小变化,甚至1 个核苷酸的变化,也能引起限制性内切酶切点的丢失或产生, 导至酶切片段长度的变化。 随机扩增多态DNA (Randomamplified polymorphic DNA ,RAPD) 技术,由于其独特的检测DNA 多态性的方式使得RAPD 技术很快渗透于基因研究的各个领域。RAPD 是建立于PCR 基础之上的分子标记技术,基本原理是利用一个随机引物(8~10 个碱基) 通过PCR 反应非定点地扩增DNA 片段,然后用凝胶电泳分离扩增片段来进行DNA 多态性研究。对任一特定引物而言,它在基因组DNA 序列上有其特定的结合位点,一旦基因组在这些区域发生DNA 片段插入、缺失或碱基突变,就可能导至这些特定结合位点的分布发生变化,从而导至扩增产物的数量和大小发生改变,表现出多态性。 扩增片段长度多态技术(AFLP) ,又名限制片段选择扩增技术(Selective restriction fragment amplifi2cation ,SRFA) ,于1993 年由荷兰KEYGENE 公司的Zabean 和Vos 等发明。AFLP 是近年来迅速发展起来的一种分子标记技术,它将基因组DNA 用成对的限制性内切酶双酶切后产生的片段用接头(与酶切位点互补) 连接起来,并通过5′端与接头互补的半特异性引物扩增得到大量DNA 片段,从而形成指纹图谱的分子标记技术。AFLP 指纹呈孟德尔式共显性和显隐性遗传。 SSR 也称微卫星DNA ,是一类由几个(多为2~6个) 碱基组成的基序串联重复而成的DNA 序列,其中最常见的是双核苷酸重复,即(CA) n和(TG) n ,每个微卫星DNA 的核心序列结构相同,重复单位数目10~60 个,其高度多态性主要来源于串联数目的不同。不同遗传材料重复次数不同,导至了SSR 长度的高度变异性,这一变异性正是SSR 标记产生的基础。 单核苷酸多态性(Single nucleotide polymorphism ,SNP) 被称为第3 代DNA 分子标记,是指同一位点的不同等位基因之间个别核苷酸的差异,这种差异包括单个碱基的缺失或插入 ,更常见的是单个核苷酸的替换,且常发生在嘌呤碱基(A 与G) 和嘧啶碱基(C 与T) 之间。SNP 标记可帮助区分两个个体遗传物质的差异,被认为是应用前景最好的遗传标记。
|  /3
/3 