登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
2014年国际血液学标准化委员会(ICSH)发布了血液分析仪评价的新指南,与该委员会1994年发布的指南相比有了很大的变化。与2010年CLSI发布的H26-A2《自动血液分析仪验证、确认和质量保证指南》和2012年我国发布的卫生行业标准WS/T406-2012《临床血液学检验常规项目分析质量要求》相比,也有不少新的要求。3个标准中既有相似的地方,又有不同的之处,在要求上WS/T406-2012和H26-A2相似,在内容上ICSH比较完整,但具体性能判断标准ICSH没有提供。现将这些文件所规定的评价、确认和验证的要求进行比较,以ICSH为主,同时列出H26-A2和WS/T406-2012的不同之处。
一、精密度 精密度为一份标本重复多次测定所得检测结果之间的一致性。取决于随机误差的分布而非准确度的测量。细胞浓度越低,被计数的细胞数量就越少,计数的不精密度就越大。在临床实践中,应建立每个参数在整个报告范围内的精密度,较WS/T406-2012要求高,我国行业标准仅规定了WBC、RBC、Hb、Hct、PLT、MCV、MCH和MCHC等8项参数,而现代大多数血液分析仪可报告参数都已达到20项以上。
1.重复精密度(批内精密度、短期精密度):常由同一标本在一个批次内重复测定10次得到。应包括正常和异常值标本。应收集所有报告参数的重复精密度,而不仅仅是WBC、Hb、PLT、Ret和NRBC参数,应计算均值、s和CV。
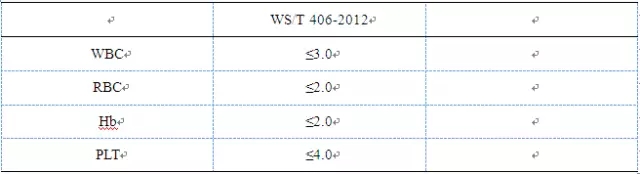
WS/T 406-2012验证要求是取在参考区间内的临床标本1份,按常规方法重复检测11次,计算后10次检测结果的均值、s和CV。重复精密度应达到厂家说明书的要求,在参考区间浓度水平的新鲜血至少应符合表1的要求。
H26-A2标准认为确认短期精密度应采用在参考区间内的临床新鲜血液标本1份连续测定31次,最低要求是在3台仪器上做4组精密度研究得到12个结果。
表1重复性精密度检测要求(CV%)
2.期间精密度(批间精密度、日间精密度、设备间精密度):受仪器校准或偏移影响。常由同一标本每天测定1次,重复测定20~30天。应包括正常和异常值标本。和重复精密度一样,应收集所有报告参数的期间精密度,而不仅仅是WBC、Hb、PLT、Ret和NRBC。因标本需保存一段较长时间,常需使用经固定的血液标本。如厂家提供的质控物,可用于评估仪器的所有参数。
WS/T 406-2012验证要求以室内质控在控数据的变异系数为评价指标,至少使用2个浓度水平(含正常和异常)的质控品,在检测当天至少做1次室内质控,剔除失控数据后按批号或月份计算在控数据的变异系数。期间精密度应符合表2的要求。
H26-A2标准认为确认设备间精密度应采用商品质控品(低、中、高)每天重复测定2次至少测定25天,得到每个参数的s和CV。 表2期间精密度检测要求(CV%)
二、携带污染 携带污染为前一标本对紧接后一标本分析的污染。临床关注的是,高值标本对随后检测的低值标本的可能影响。通常做法是检测高值标本3次,随后检测低值标本3次,计算携带污染率(携带污染率(%)=(低值第1次测定结果-低值第3次测定结果)/(高值第3次测定结果-低值第3次测定结果)。应包括WBC、Hb、PLT、Ret和NRBC参数,应至少测定3份标本。和WS/T406-2012要求类似,但需特别关注新增的Ret和NRBC两个定量计数参数,同时要求用3份标本来评价携带污染率,以便能得到结果分布范围。
WS/T 406-2012验证要求是取1份高值临床样本,连续测定3次,再取1份低值临床样本,连续测定3次,计算携带污染率。标准对临床标本取值范围作了规定(见表3)。
H26-A2标准认为确认时应做3台仪器至少9组携带污染的研究数据。参数也只要WBC、RBC、Hb和PLT,但需计算4个参数携带污染的置信区间,且不能使用商品质控品作为标本。
表3携带污染率检测标本要求
携带污染率应符合表4的要求。 表4携带污染率检测要求(CV%)
假设仪器没有恒定偏移,线性为仪器直接提供与细胞浓度呈正比结果的能力。线性范围越宽越好,应选择分析测量范围(AMI)从最低到最高的各种稀释度。若曾遇到极低浓度WBC和PLT时,最好对低值线性进行独立评价,如PLT50×109/L做一系列稀释到5×109/L,WBC2×109/L做一系列稀释到0.2×109/L。某些血液学参数如红细胞指数或可报告结果为百分数的参数,则不受标本稀释的影响,无需做线性评价。
三、线性 分析测量范围为不做稀释、浓缩或其他非常规预处理操作,对标本直接测定所得的测量范围。常由已知异常高值和低值患者标本或使用已知高值和低值校准品完成。应绘制线性回归图,X轴为标本浓度、Y轴为细胞计数或浓度,回归线应通过原点,相关系数(r)应尽可能接近1.0。应注意的是,仪器精密度会影响线性结果,在评价线性前应加以考虑。
在用于患者标本检测前,临床实验室应确认仪器的可报告范围(CRI)。分析测量范围为测量方法可检测的分析物测定值的范围,即允许对标本进行稀释、浓缩或其他预处理,用于扩大AMI。当患者标本不可用时,厂家提供的线性核查品也可使用。
WS/T 406-2012对WBC、RBC、Hb和PLT参数验证要求是线性回归方程斜率在1±0.05范围内,相关系数r≥0.975或r2≥0.95,或在厂家说明书规定范围内。
四、可比性 可比性为比较待评估仪器与常规仪器每个参数的测定结果。将两者检测结果作图,显示待评估仪器(Y轴)与常规仪器(X轴)检测结果之间的差异,采用回归分析、相关分析和BlandAltman散点图进行一致性评估,相关系数代表落在直线上的数据是否在仪器分析范围内,越接近1.0越显示线性。当结果呈正态分布时应采用配对t检验,呈非正态分布时应采用Wilcoxon秩和检验或MannWhitney U检验,以P<0.05代表差异有统计学意义。当待评估仪器测定结果与常规仪器的结果存在离群值时,应采用参考方法检测标本。当有些参数不可能与另一种方法进行比较时(即某型号仪器独有的指标),应确定是否与患者诊断和临床情况一致且适当。
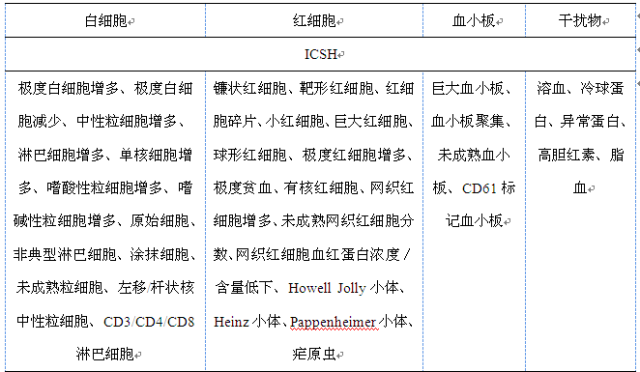
应尽量使用正常和异常标本(包含干扰物的标本,见表5),正常标本应占总数1/2~1/3,总标本量至少为250~300份。标本应至少能在1周或更长时间内检测。
表5评价应包含的异常标本和潜在干扰物

H26-A2标准认为确认可比性是取新鲜血液标本在待评价仪器和常规仪器上进行重复测定,结果应在预期偏移目标内,统计学应采用Passing-Bablok回归分析来解释结果,斜率和截距均应在95%置信区间内,且两种方法差异没有统计学意义。WS/T 406-2012使用正确度术语,以偏移为评价指标,至少使用10份在参考区间内的新鲜血标本,每份标本检测2次,计算20次以上检测结果的均值,以校准实验室定值(实际工作中不能实现)或临床实验室内部规范操作检测系统(仅一台仪器的临床实验室不能实现)测定均值为标准,计算偏移。每个参数的偏移符合表6要求。
表6偏移检测要求(%) 表7偏差检测要求(%) WS/T 406-2012使用可比性术语,以偏差为评价指标。在新仪器使用前,若为配套检测系统,至少使用20份临床标本(正常、异常浓度水平各占50%),每份标本用临床实验室内部规范操作检测系统和待比对仪器进行检测,以内部规范操作检测系统的测定结果为标准,计算相对偏差。若为非配套检测系统,则至少使用40份临床标本。每个参数的相对偏差应符合表7要求比例应≥80%。
五、准确度 准确度为检测结果与已知真值之间的一致程度。真值概念不适于全血细胞计数(CBC)的许多参数。真值由决定性参考方法获得,有参考方法的相关参数仅为WBC、RBC、Hb、Hct、PLT、Ret和白细胞分类计数。
除已知的WBC、RBC、Hb、Hct和PLT参考方法外,Ret参数推荐采用荧光染料染色的流式细胞术,该法检测精密度高于手工法。白细胞分类计数参数推荐采用CLSIH20-A2手工法(即手工分类400个白细胞分类)或流式细胞术免疫表型计数候选参考方法,使用8种及以上配合组合方案(如CD16、CD45、CD7、CD123、CD14、CD3、CD11b和Syto16),特点是一次分析即能明确识别淋巴细胞、单核细胞、粒细胞、浆细胞、原始细胞和有核红细胞。
WS/T 406-2012验证要求至少使用5份质评物或定值临床样本分别进行单次检测,计算每份样本检测结果与靶值(公议值或参考值)的相对偏差,以总误差为评价指标。每个参数的相对偏差符合表8要求的比例应≥80%。 表8准确度的允许相对偏差(%)
六、标本稳定性 标本稳定性为规定时间段和特定限值内,规定条件下贮存标本维持测定值一致性。通常CBC各种成分数量随静脉采血后时间而变化,其检测结果可能变高或变低。 应采用5份正常标本和5份异常(非相同细胞系异常)标本,在采集的零时间点(或尽可能接近此时间点)分析,然后将血液标本分成2套,每套6支,一套贮存在室温,另一套贮存在4℃,随后在4h、8h、12h、24h、48h和72h后分别检测标本。通过计算各时间点测定结果与初始(零时间点)检测结果的差值,得到检测结果-检测时间图,以评估贮存时间和温度对结果的影响。WS/T406-2012标准中未规定需要验证此项。
七、参考区间 在仪器评价期间应建立仪器全部参数的特定参考区间。理想情况下,应在静脉采血后4h内完成至少120份(男、女各60份)明显正常的个体标本的检测。如有可能,应考虑性别和种族分组。如需要应建立新生儿和不同年龄儿童的参考区间。每组应计算均值、s和95%置信区间。若数据呈正态分布,参考区间是从均值-2s到均值+2s。若数据呈非正态分布,做MannWhitney U检验,参考区间采用百分数和置信限来表示。
八、进样模式 当仪器采用独立进样路径(如闭盖自动进样、手工开盖或预稀释进样)的多种进样模式时,应测试所有模式的性能。应评价仪器所有模式的精密度、携带污染和线性和一定数量标本(至少30份)的不同进样模式间的可比性。 WS/T 406-2012验证要求是在仪器校准后,取5份临床标本分别使用不同模式进行检测,每份标本检测2次,分别计算两种模式下检测结果均值间相对差异,结果应符合表9的要求。 H26-A2标准认为确认模式间比较需取决于血液分析仪本身设备的物理特性。若吸样路径、吸样量和分析模式相同,仅需做单次校准;若吸样路径、吸样量、分析模式不同,需要对不同模式进行校准;若吸样路径相同,但吸样量和分析模式不同,校准方法可相同也可不同,但厂家应证明差异程度,并证明单次校准的等效性;若吸样路径不同,但吸样量相同,需要对不同路径进行校准。需确认的性能特征包括空白限、携带污染、精密度、检出限和定量限、分析测量范围和可比性。 表9不同吸样模式的结果间相对差异(%) WS/T 406-2012验证要求是用稀释液作为标本在血液分析仪上连续检测3次,3次检测结果的最大值应在允许范围内,见表10。九、本底计数
H26-A2标准认为空白限就是本底计数,通常应考虑WBC、Hb、PLT参数,每日仪器启动的本底计数值应在厂家操作手册规定范围内。若需统计学评价空白限可按CLSIEP17文件。
表10本底计数检测要求 H26-A2标准认为,检出限为标本中可测量的分析物最少量,对血液分析仪来说就是能与本底计数区分的各种血细胞的最低浓度值;定量限为可接受精密度和正确度条件下可定量测定的分析物最少量,对血液分析仪来说是符合性能目标的WBC和PLT最低浓度。十、检出限和定量限
WBC和PLT检出限的确认方法是由本底计数加上常数得到(可参照CLSIEP17文件)。定量限的确认方法是采用几个标本至少重复测定60次(如6个标本分别重复测定10次)得到,计算得出均值、s和CV,其CV应小于预期允许范围,如按美国CLIA要求,WBC为15%,PLT为25%;按德国医学会要求,WBC为4%,PLT为6%。RBC、Hb和Hct常数没有必要提供检出限和定量限。
十一、 数字成像血液系统评价 随着计算机系统、复杂处理能力和图形分析软件的改进,以及人工神经网络的出现,数字成像血液系统已重回血常规分析领域。此类系统分为下列两种类型。 (1)具备预分类功能的细胞定位系统:即数字化细胞定位/预分类系统,由检验人员决定所有细胞(正常和异常)的最终分类,该系统对细胞的准确识别取决于血涂片质量和染色质量。该系统应评估的性能特征包括精密度(可重复性)、准确度、可比性、诊断灵敏度和诊断特异度。 (2)数字成像血液系统:即数字成像CBC/分类/Ret血液分析仪,可做CBC、白细胞五分类和Ret。当检出异常细胞时,仪器会报警,让有经验的检验人员进行复检。该系统应评估的性能特征包括精密度、准确度、可比性、携带污染、线性、诊断灵敏度和诊断特异度、检出限/定量限和参考区间。影响电阻法或光学法血液分析仪的干扰物质(如脂血、胆红素血症、副蛋白血症等)不会影响数字成像血液系统,而缗钱状红细胞、冷凝集和RBC聚集等会影响该系统检测结果,应谨慎而全面的评价此类系统的性能。
十二、 POCT血液分析仪评价 POCT为临床实验室外由医护人员为患者所做的任何分析试验。POCT设计是将临床实验室检测靠近患者,所提供服务比来自中心实验室的服务更便捷。从设计用于患者床边、重症监护室或手术室的手持式POCT设备到小型台式POCT分析仪,虽各不相同,但最终检测结果均应与主要的血液分析仪进行比较。理想情况下,一个机构不同地点有多台POCT仪器时,只能选择一种型号的仪器,这样才能保证患者的检测结果和参考区间相同。应在仪器使用前做性能评价,通常POCT仪器用户的检测质量要逊于有经验的检验人员。 WS/T 406-2012标准提供了简便易行验证方法,但大多数参数未提供验证方法和标准,尤其是白细胞分类参数。H26-A2标准提供了大部分参数的可参考质量要求,明确了厂商需确认的性能特征(包括空白限、携带污染、精密度、分析测量范围、检出限和定量限、可比性和干扰等)和具体要求,规定了临床实验室应验证的性能特征(包括准确度、精密度、可报告范围和参考区间)。ICSH标准体现了现代血液分析仪的性能评价要求,但没有提供具体的质量指标,在临床实验室常规使用中会遇到困难。总之,现行的3种不同标准各有千秋,很难在临床实践中统一应用。
来源:上海中医药大学附属龙华医院检验科 胡晓波
|  /3
/3 