|
今天我们从范围、判定依据、以及临床试验审批对于产品注册流程及审评审批时限的影响等方面为您解析《需进行临床试验审批的第三类医疗器械目录》。
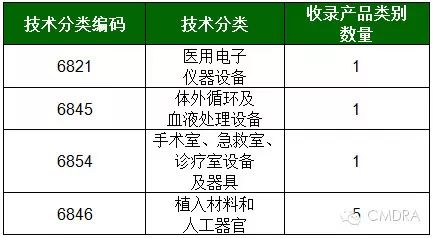
依据《医疗器械注册管理办法》第二十五条之规定:临床试验审批是指国家食品药品监督管理总局根据申请人的申请,对拟开展临床试验的医疗器械的风险程度、临床试验方案、临床受益与风险对比分析报告等进行综合分析,以决定是否同意开展临床试验的过程。 从技术分类来看,《需进行临床试验审批的第三类医疗器械目录》(以下简称《目录》)涵盖4个技术分类下的8个产品类别,详情请参见下表。
另外需要提醒申请人注意的是,并非《目录》覆盖的所有类别的产品均须进行临床试验审批。《目录》进一步明确了是否进行临床试验审批的判定依据: 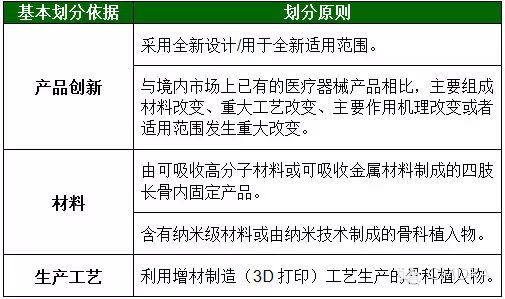
与其他产品相比,列入《目录》的产品在注册的临床试验阶段多了哪些步骤?
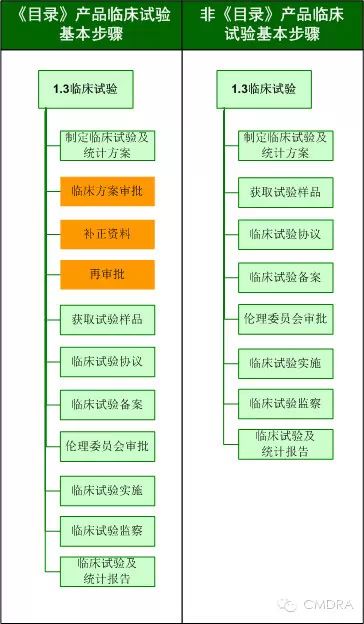
最后,与其他产品相比,列入《目录》的产品在审评审批时限方面有何区别? 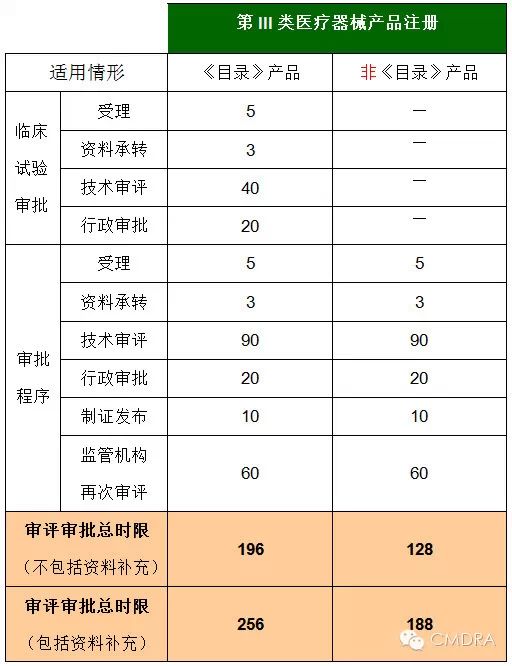
本文转自CMDRA
|  /3
/3 